Description
Le plateau de transgénèse est destiné à produire de nouvelles lignées de souris génétiquement modifiées par mutagénèse insertionnelle ou par recombinaison homologue. Le service de transgenèse permet d’établir les nouvelles lignées de souris mutantes par injection des cellules ES modifiées, fournies par les chercheurs, dans des blastocystes.
Il assure ainsi toutes les étapes conduisant à la transmission germinale de la mutation introduite dans les cellules ES injectées : production de blastocystes, production de femelles pseudo-gestantes, micro-injection des cellules ES dans des blastocystes, réimplantation de ces blastocystes dans des femelles pseudo-gestantes, gestion des accouplements des animaux chimériques pour la transmission germinale.
Contact
Tiffany Marchiol, Ingénieure, Université de Limoges
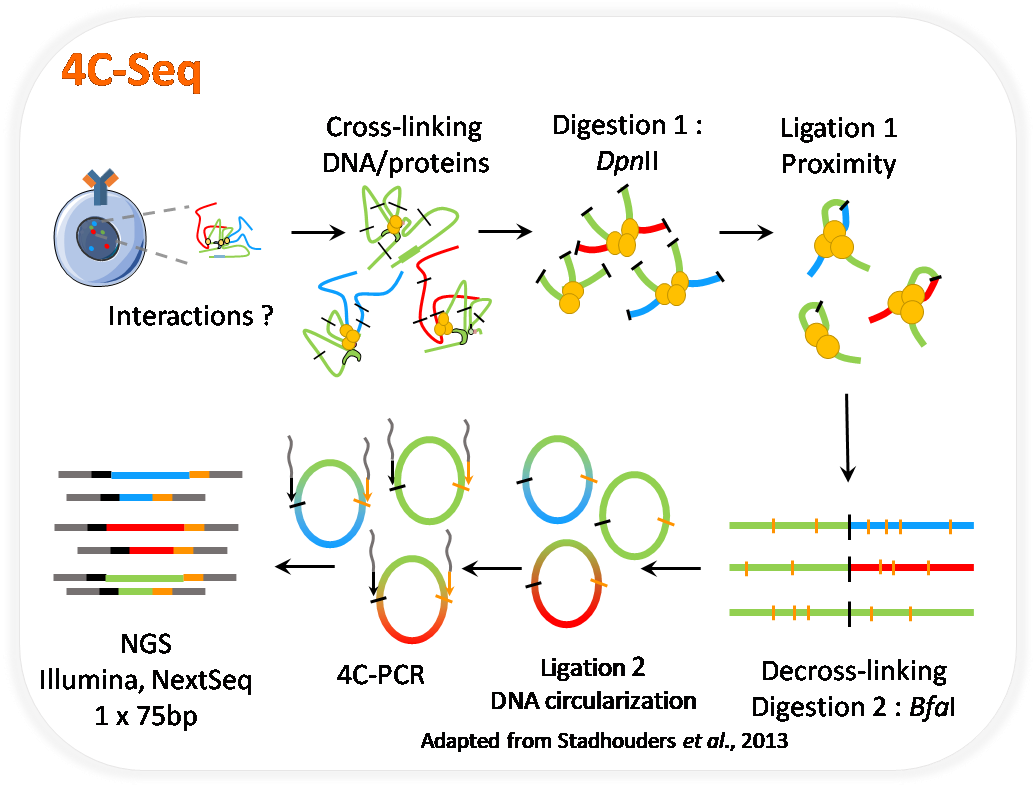
3C & 4C-seq
CRIBL s’intéresse depuis de nombreuses années au rôle des enhancers IgH sur les évènements de CSR et SHM. L’avènement des nouvelles techniques de biologie moléculaire et du sequençage à haut débit a permis de revisiter l’étude des de ces enhancers. Le laboratoire maitrise les techniques 3C et 4C-seq (Circular Chromosome Capture Conformation) qui permettent l’étude des intéraction génique à l’échelle du génome. La 4C-seq est réalisée en collaboration avec Pedro P. Rocha (Unit On Genome Structure and Regulation, NIH).
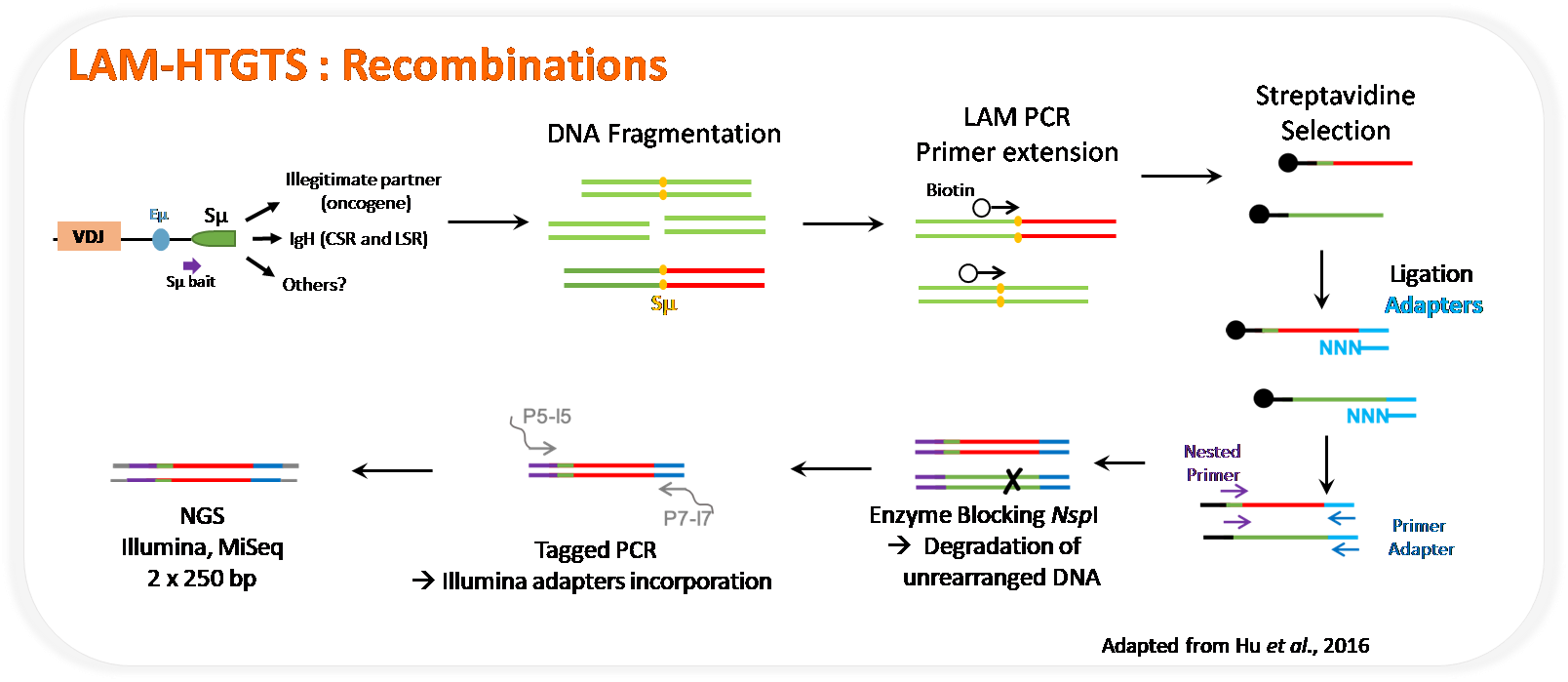
LAM-HTGTS
La technique de LAM-HTGTS (linear amplification-mediated high-throughput genome-wide sequencing) est une méthode pour la détection à l’échelle du génome de remaniements légitimes ou de translocations à partir d’un endroit donné du génome (nommé bait).
Ces 2 techniques couplées permettent l’étude du rôle des enhancers du locus des chaines lourdes d’immunoglobulines (Eµ-MAR et 3’RR) sur le maintien de l’organisation du génome du lymphocytes B en étudiant : l’organisation spatiale du lymphocyte B (ie : repliement du locus IgH sur lui même et interaction avec des gènes partenaires) et les remaniements génomiques légitimes (CSR) et illégitimes (translocations).
Contact
Sandrine Le Noir, CR, CNRS
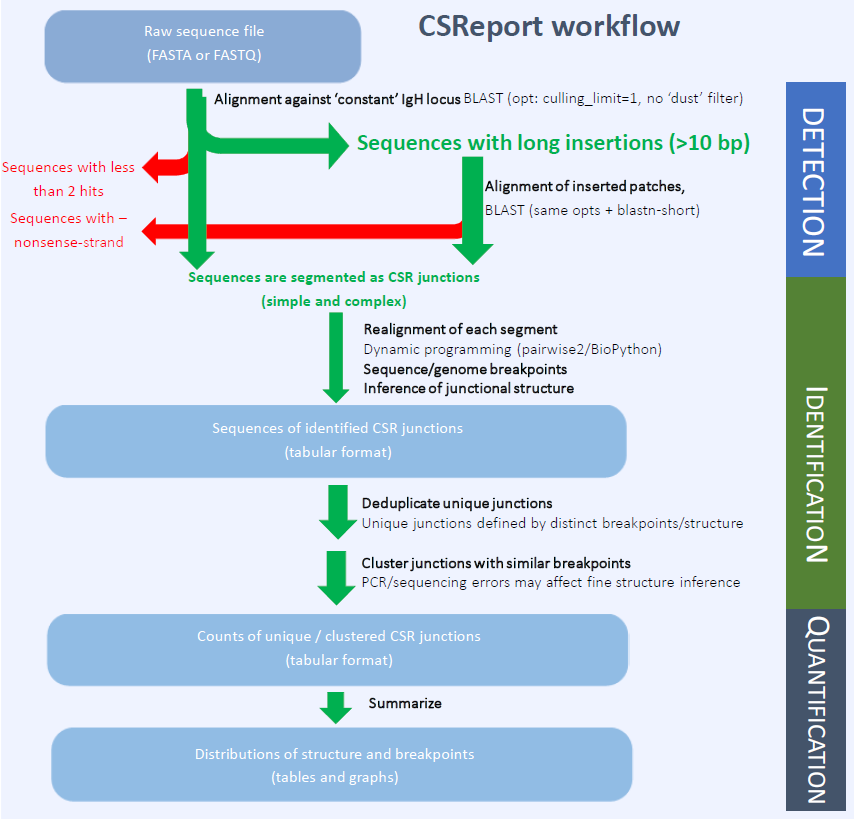
CSReport
Le laboratoire a développé un outil bio-informatique permettant l’étude des jonctions de recombinaison du locus IgH (switch de classe, CSR, et recombinaison de suicide du locus, LSR) : CSReport.
Cet outil a été conçu pour permettre une analyse automatique à partir des données de séquençage à haut débit (J Immunol. 2017 May 15;198(10):4148-4155).
CSReport identifie les jonctions de recombinaison à partir de l’alignement des reads de séquençage haut débit sur les séquences de référence. CSReport détermine les points de rupture sur chaque segment mis en jeu dans la jonction avec une résolution de 1 pb et détermine les motifs de 8 nucléotides les plus fréquemment ciblés. CSReport analyse la structure des jonctions (jonctions avec insertion, franches et avec microhomologies). Temps d’analyse : ≈ 30 mins/106 séquences.
CSReport nécessite les environnements Python3 et Jupyter (de préférence à partir d’une distribution Anaconda) avec un package Biopython mis à jour. Le fichier notebook CSReport (archive ZIP) incluant les fichiers de référence est disponible sur demande.
Contact
Sophie Péron, CR, INSERM
DeMinEr
CRIBL a également développé un outil permettant l’étude des mutations rares. DeMinEr permet la détection de rares mutations induites par l’AID à partir de données de séquençage à haut débit par une approche de correction d’erreur induite par le séquenceur en séquençant en parallèle un échantillon non muté (J Immunol. 2018 Aug 1;201(3):950-956).
Contact
Eric Pinaud, DR, CNRS
Description
Le laboratoire CRIBL focalise ses recherches sur les lymphocytes B, qu’ils proviennent de souris ou de biopsies humaines, ou bien qu’ils soient normaux ou malins.
Nous avons développé plusieurs protocoles de routine en cytométrie de flux et en microscopie à fluorescence pour contribuer à l’analyse de modèles murins et des échantillons humains.
Contact
Claire Carrion, Ingénieure, CNRS
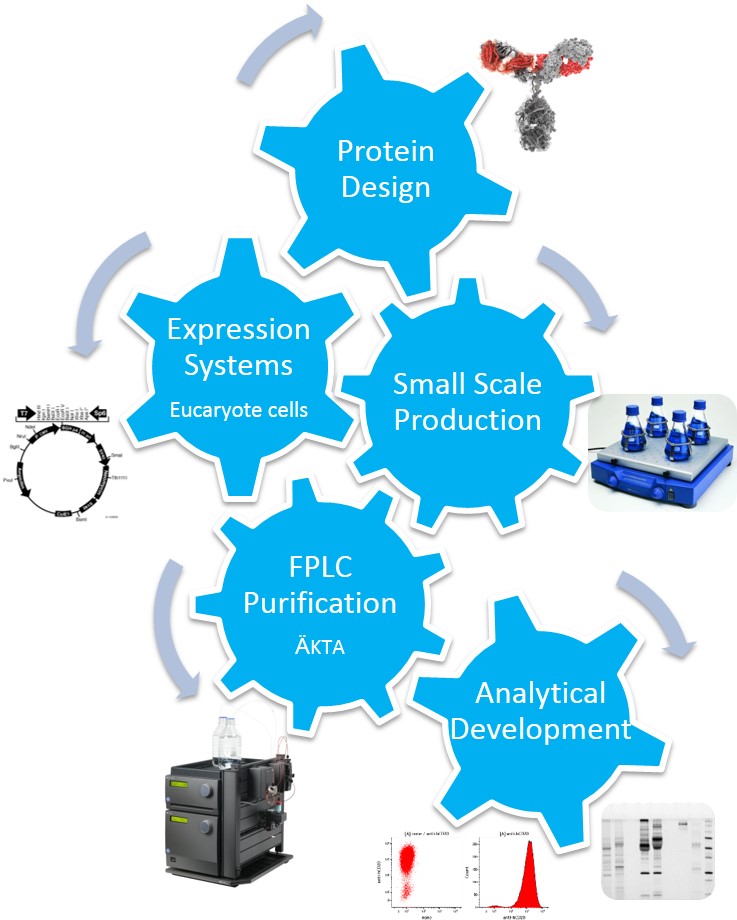
Ingénierie des protéines de l’immunité
Le laboratoire CRIBL dispose d’un mini-plateau interne de production et purification de protéines, principalement axé autour de l’immunoglobuline. Ce plateau regroupe des équipements destinés à la surexpression, la purification et l’analyse de protéines.
Certains équipements sont commun au laboratoire : des pièces de culture cellulaire avec hottes, incubateurs et agitateurs ou encore une pièce d’analyse de protéines avec le matériel de SDS-PAGE, de western-blot, révélation ChemiDocTouch (Bio-rad) et spectophotomètre.
L’équipement de purification est propre au mini-plateau technique : la purification de protéines s’effectue à l’aide d’un ÄKTA FPLC en enceinte réfrigérée avec un panel de colonnes de purification (affinité, exclusion de taille), sous la supervision du responsable.
Contact
Christelle Oblet, Assistante Ingénieure, CNRS
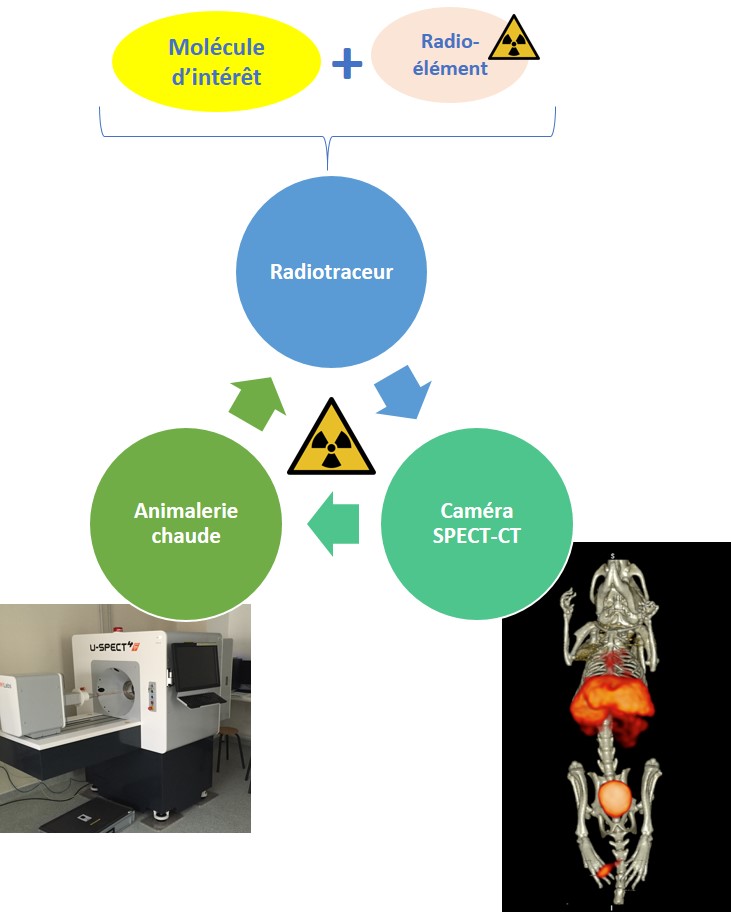
Approches de radioimmunothérapie
CRIBL a accès à une caméra SPECT couplée à un scanner, dédiée petit animal (rat, souris), permettant après administration d’une molécule radiomarquée à l’aide d’un émetteur gamma (99mTc, 123I, 111In,…) le suivi de la répartition de ce composé dans l’organisme.
Ce type de technologie peut être appliquée à l’étude de la biodistribution d’une molécule d’intérêt (après mise au point de son radiomarquage en collaboration avec le service de Médecine Nucléaire du CHU), mais aussi au suivi de diagnostic ou de suivi tumoral par scanner ou à l’aide traceur disponibles.
Contact
Stéphanie Durand-Panteix, Ingénieure, Université de Limoges
Plateforme de Cytométrie en flux
Le plateau de Cytométrie et Imagerie en flux, située au sein du pôle Bio-santé de l’université de Limoges, fait partie de l’unité de service BISCEm US 42 INSERM / UMS 2015 CNRS.
La plate-forme possède les compétences scientifiques et techniques pour la mise en œuvre de projet depuis la préparation des échantillons jusqu’à l’analyse des données et assure les prestations ainsi que les formations nécessaires.
Ses ressources permettent de caractériser et séparer des populations de cellules, procaryotes comme eucaryotes, ou de particules (vésicules, nanoparticules, organites…) pour la recherche fondamentale et/ou clinique en immunologie et hématologie.
La plate-forme propose une aide à la conception des expériences (en particulier sur le choix des fluorochromes) une aide à l’analyse, à l’interprétation et à la présentation des résultats. Elle adapte ses appareillages en répondant aux nouvelles attentes et besoins des utilisateurs en développant de nouvelles techniques (Imagerie en flux).
Nous proposons également une formation théorique et pratique à l’utilisation de chaque cytomètres analyseurs et si besoin du trieur de cellules. L’objectif de cette formation est que tous les utilisateurs deviennent rapidement autonomes et indépendants quant à l’utilisation des cytomètres.
Contact : Catherine Ouk, Ingénieure, CNRS
Plateforme de Microscopie
Localisée au sein du Centre de Biologie et de Recherche en Santé, la plateforme de microscopie en fluorescence fait partie de l’unité de service BISCEm US 42 INSERM / UMS 2015 CNRS. Elle est ouverte à l’ensemble des laboratoires de l’université de Limoges ainsi qu’aux structures extérieures, qu’elles soient publiques ou privées.
Elle met à disposition des utilisateurs des systèmes de microscopie de fluorescence et d’analyse d’images en utilisation libre ou assistée par l’ingénieur de la plateforme.
Contact : Claire Carrion, Ingénieure, CNRS