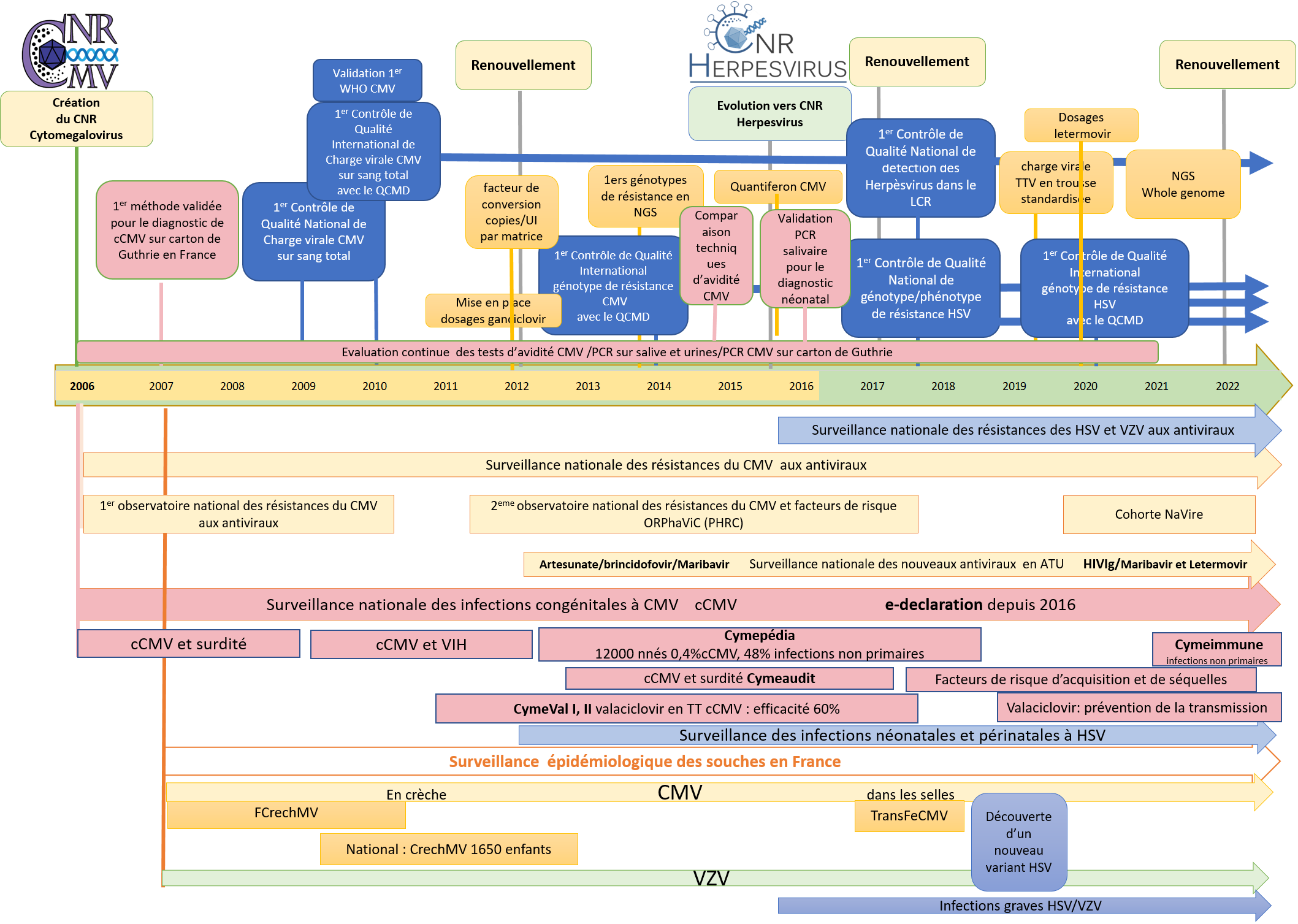
A la une! 
Dépistage systématique national de l’infection à CMV chez la femme enceinte:
Ces derniers mois, la Haute Autorité de Santé (HAS) a évalué la pertinence d’un dépistage systématique de l’infection à cytomégalovirus (CMV) au cours de la grossesse et a mis en ligne le 17 juin 2025 des recommandations en santé publique.
Aujourd’hui, la HAS recommande :
- De mettre en place un dépistage systématique national, à destination de toutes les femmes enceintes dont le statut sérologique est négatif ou inconnu. Cette mesure fera l’objet d’une réévaluation au terme de trois années de mise en œuvre, afin d’en apprécier la pertinence et d’envisager éventuellement sa reconduction.
- La poursuite du dispositif, au-delà de cette période initiale de 3 ans, sera conditionnée à une évaluation reposant sur des données scientifiques complémentaires. Ces données devront être produites à travers : la mise en place d’études spécifiques, le développement de systèmes d’information adaptés, ou encore l’ajustement des dispositifs existants de collecte de données.