Un pipeline instrumental et computationnel pour visualiser des particules virales de SARS-CoV-2 en suspension An instrumental and computational pipeline for visualizing free viral particles in suspension
Erwan FERRANDON ,
Mathis COURANT ,
Camélia POPESCU ,
Yann LAUNAY ,
Sophie ALAIN
et Claire LEFORT
La compréhension des modes d’actions biologiques des virus dans une cellule hôte est un sujet complexe pour lequel nous pensons que les solutions optiques pourraient apporter des éléments de réponse nouveaux. Cependant, les dimensions des particules virales sont environ 3 fois plus petites que la résolution d’un microscope optique. Nous proposons de tester une nouvelle stratégie instrumentale et computationnelle, reposant sur la microscopie multiphotonique, pour visualiser des objets dont les dimensions sont de l’ordre de quelques centaines de nanomètres. Cette stratégie repose sur la prise en compte de la réponse impulsionnelle de l’instrument (PSF pour Point Spread Function) in situ, modélisée mathématiquement. A partir de ce modèle qui prend en compte les distorsions optiques locales, un post-traitement numérique des images est appliqué en vue d’optimiser la qualité visuelle des images. Nous faisons des tests sur deux populations de virus : les Cytomégalovirus (CMV) et le SARS-CoV-2.
The understanding of the biological actions of viruses in a host cell is a complex subject, intensly studied in the last years, and the optical solutions could provide new answers. However, the dimensions of viral particles are about 3 times smaller than the resolution of a standard optical microscope. This characterization can be performed using higher resolution approaches. Consequently, we propose to test a new instrumental and computational strategy, based on multiphoton microscopy, to visualize objects with dimensions of the order of a few hundred nanometers, and to compare these images with the ones obtained by electron microscopy The multiphoton microscopy strategy is based on the consideration of the instrumental point spread function (PSF) in situ, mathematically modeled. From this model, which takes into consideration the local optical distortions, a numerical post-processing of the images is applied in order to optimize the visual quality of the images. We have conducted tests on two populations of viruses : Cytomegalovirus (CMV) and SARS-CoV-2.
Introduction
Les infections virales sont des pathologies pour lesquelles la recherche a eu un regain d’intérêt ces dernières années, notamment avec la crise Covid. Les recherches portent par exemple sur le rôle et les mécanismes suivis par les particules virales qui mènent à l’infection d’une nouvelle cellule hôte. Les particules virales sont composées de protéines de surface, comme par exemple la protéine Spike pour le SARS-CoV-2. Ces particules sont incluses dans une enveloppe faite de lipides protégeant une capside protéique contenant le matériel génétique (ADN ou ARN) ainsi que les protéines nécessaires à la synthèse de nouvelles particules virales au sein de la cellule infectée [1]. La fluorescence endogène est un phénomène qui peut se produire dans de nombreux organismes vivants. Souvent considérés comme parasite, ce signal émis de façon endogène peut cependant révéler des informations intéressantes sur la composition des organismes [2]. Pour apporter de nouvelles informations sur les modes d’actions biologiques des virus dans une cellule hôte, l’idée est de révéler à l’image la présence des particules virales comme celle du SARS-CoV-2 sous leur forme la plus simple. Pour cela, nous cherchons à imager la fluorescence endogène des virions de SARS-CoV-2 [3, 4].
Dans la littérature, on trouve différentes techniques d’imageries ont été utilisées pour visualiser le SARS-CoV-2 [#1, #2, #3]. L’une des solutions les plus utilisées pour visualiser les virus dans leur intégrité est la microscopie électronique à balayage [#4]. Comme l’a reconnu Roingeard P. et al. [#2], la microscopie électronique joue un rôle essentiel dans la visualisation de virus mais son principal inconvénient est son coût d’acquisition et de maintenance ainsi que la complexité de préparation des échantillons dans le but d’obtenir une image exploitable d’une cible non détruite. Par conséquent, le besoin en une nouvelle solution instrumentale optique apparaît afin de permettre une visualisation en quasi direct et sans contact ni traitement de la cible par l’utilisation du microscope multiphotonique. La combinaison et complémentarité de ces solutions pourrait alors nous offrir une meilleure interprétation de nos résultats. Ici, nous proposons une observation de ces particules virales par un microscope multiphotonique sans modification ou altération chimique de la particule virale libre. La source laser nous permettant d’exciter l’échantillon dans le proche infrarouge, il est possible d’observer l’échantillon en profondeur tout en gardant une bonne résolution axiale et en limitant la phototoxicité [5, 6]. Cependant, la moins bonne résolution par rapport à d’autres techniques d’imagerie est majeure. Les objets de dimensions inferieures à la limite de diffraction, comme c’est le cas pour les souches virales de SARS-CoV-2, sont affichés à l’image avec une forme étalée par rapport à leur réalité. Les images acquises en microscopie optique font ensuite l’objet d’un traitement numérique reposant sur une déconvolution associée à un traitement du flou et du bruit. Pour cela, le traitement des images en trois dimensions a été effectué à l’aide de la chaine instrumentale et computationnelle FAMOUS, mise au point en collaboration avec CentraleSupélec [7].
Des souches virales (VHLE) de cytomégalovirus (CMV) ainsi que des souches de SARS-CoV-2 ont été utilisées pour réaliser des acquisitions en microscopie optique. Les souches de CMV ont été utilisées dans cette étude en raison de leur taille, 300 nm de diamètre, légèrement plus grand que la résolution optique théorique du microscope multiphotonique. Ensuite, des essais sur le SARS-CoV-2 de 80 à 120 nm de diamètre ont été réalisés.
1. Matériels et méthodes
1.1. Les particules virales libres
Les particules virales de SARS-CoV-2 et de VHLE, ont été cultivées dans le laboratoire P3 du CHU de Limoges à partir de cellules infectées dans du milieu de culture cellulaire. Après 3 jours d'infections [8], les solutions ont été clarifiées puis conservées à -80°C. Les débris cellulaires ont été centrifugés pour les séparer du surnageant, ce dernier a ensuite été prélevé puis passé aux UV pendant 30 secondes pour inactiver les particules virales. Le milieu a été filtré par centrifugation dans des tubes Amicon de 4mL pendant 10 min à 5000 g. Le filtrat recueilli (200 μL) a été transféré dans des tubes Eppendorf de 2 ml et dilués de moitié dans du PBS. Les particules virales ont ensuite pu être filtrées via des billes sur un rack magnétique : 40 µL de billes magnétiques ont été ajoutés à la solution de virion pour une incubation de 10 minutes à température ambiante et 30 minutes sur portoir magnétique. Les billes magnétiques ont été rincées deux fois avec du PBS ou H2O sur un portoir, puis mises en suspension dans 100 μL de PBS ou H2O. 10 μL de la solution résultante contenant les virions libres ont été déposés entre lame et lamelle pour observation au microscope. Les préparations en suspension dans de l’H2O ont été utilisées pour les observations au microscope électronique à balayage environnementale. L'utilisation de billes magnétiques se fixant aux virions ont également permis une meilleure filtration du milieu de culture des souches virales ainsi qu'une agglomération des particules virales facilitant leur repérage au microscope électronique et au microscope multiphotonique.
1.2. Microscopie multiphotonique et traitements computationnels
Les échantillons ont été imagés par microscopie biphotonique avec une source laser standard Titane-Saphir femtoseconde (800 nm, 4 W, 150 fs, 10 nm, Chameleon Ultra II, Coherent) et observés au microscope Olympus, modèle BX61WI. L’objectif de microscope Olympus XLPlan N 25x puis l’objectif Olympus LUMFL N 60x ont été successivement utilisés. Les filtres optiques utilisés pour collecter le signal émis par les échantillons sont compris dans des gammes de longueurs d’onde de 260 à 630 nm. Les acquisitions d’images en trois dimensions ont été réalisées avec un pas de 10 nm entre chaque image sur l’axe Z. La puissance moyenne utilisée pour les observations était de 10 mW.
Les images ont été exploitées avec le logiciel ImageJ et le traitement numérique a été réalisé avec l’algorithme FIGARO, intégré à la chaine instrumentale et computationnelle FAMOUS [7]. La 1ère étape de ce traitement consiste à modéliser la réponse impulsionnelle de l’instrument, appelée « fonction d’étalement du point » ou « Point spread function » (PSF) en anglais. Cette PSF résulte d’une mesure simultanée réalisée dans la chaine instrumentale et computationnelle FAMOUS, sur les échantillons eux-mêmes, donnant alors une PSF prenant en compte les spécificités de la cible imagée et non pas une PSF théorique comme cela est parfois l’usage.
1.3. Microscope électronique à balayage (MEB)
Le microscope électronique à balayage en mode environnemental (MEBe), modèle FEI ESEM Quanta 450 FEG, a été utilisé. L’intérêt de cette méthode est de donner une image de référence à partir d’un instrument à haute performance de résolution afin d’avoir un repère visuel de la cible en présence. La pression dans la chambre était comprise entre 500 et 650 Pa, le voltage compris entre 5 et 10 kV, le mag à 30000-50000 et l’humidité de la chambre entre 70 % et 95 %. La température a été maintenue constante à 2°C avec un taux d’humidité de 92 %. Pour obtenir une image satisfaisante du virus, l’échantillon a d’abord été déshydraté avant d’être introduit dans la chambre du microscope électronique. L’échantillon est préalablement humidifié afin que le séchage lié aux conditions de vide ne soit pas trop rapide et permette l’enregistrement d’une image. Une optimisation du contraste pourrait être obtenue à l’aide d’une surface conductrice.
2. Résultats
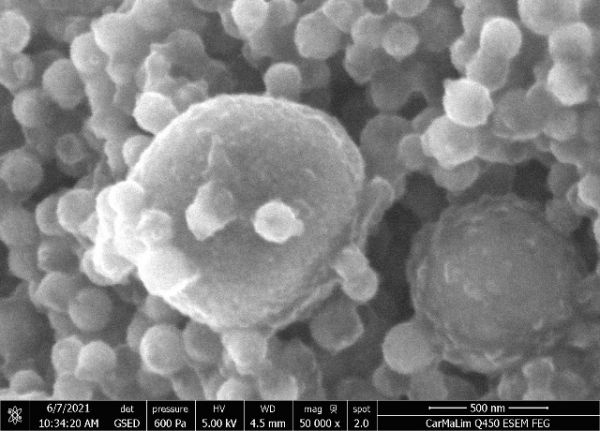
La Figure 1 représente l’image obtenue en MEBe. Les particules virales (Figure 1A) entourent les billes magnétiques (Figure 1B). Les billes magnétiques présentent une surface plus lisse et une zone plus foncée au niveau de leur enveloppe que les particules virales. Les particules virales sont identifiées à la Figure 1A par des astérisques rouges. La forme des particules virales ainsi que leur taille semblent correspondre aux gammes de dimensions attendues. On note que les zooms prolongés à haute pression par le microscope induisent la destruction de ces dernières en quelques secondes. Néanmoins, ces images ont permis une meilleure compréhension des observations au microscope multiphotonique dans la répartition des particules virales dans l’échantillon.
Figure 1 : Images observées au MEB de particules virales de SARS-CoV-2 couplées à des billes magnétiques (A) et de billes magnétiques seules (B)
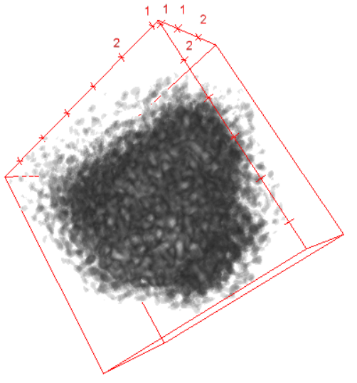
La Figure 2 présente les images de virions CMV après l’étape de concentration à l’aide des billes magnétiques. On observe ainsi un agglomérat d’objet dont il n’est pas possible de distinguer de détails à partir de l’image brute (Figures 2A et 2B). La Figure 2C illustre en 3D les agglomérats après passage des images dans la chaine computationnelle de restauration. On observe un assemblage de sphéroïdes dont il est possible, pour chacune d’entre-elles individuellement, d’associer une particule virale de CMV. En dehors de cet agglomérat, il est difficile d’associer à des sphéroïdes, observées à l’image, une particule virale libre du fait d’un niveau élevé de bruit inhérent à la méthode de mesure par MEBe. Dans cette dernière situation, il n’est pas possible de discriminer clairement un sphéroïde résultant de la présence effective d’une particule virale libre par rapport à un signal résultant d’un artéfact lié à la reconstruction des images.
Figure 2 : Images observées microscopie multiphoton de particules virales de CMV. (A) Image brute 2D. (B) Image brute 3D. (C) Image 3D reconstruite à l’aide de la chaine instrumentale et computationnelle FAMOUS.
3. Discussion
Les observations obtenues au microscope électronique à balayage environnemental (MEBe) nous ont permis de confirmer la présence des virions de SARS-CoV-2 et de cytomégalovirus (CMV) et d’avoir une idée précise de leur répartition sur la lame de microscope. Ainsi, l’intérêt de ces images MEBe de référence est de nous guider lors de l’enregistrement des images observées au microscope multiphoton présentées précédemment. Des amas ont été observés au MEBe à l’intérieur desquels la présence de zones plus sombres à la surface des particules virales ont été identifiées. Ce phénomène peut être lié à la différence de pression à l’intérieure de la chambre du microscope, finissant par rompre l’enveloppe des virions au bout de quelques dizaines de secondes. Par ces enregistrements de référence, nous avons ainsi pu mieux appréhender la constitution des échantillons. Les données acquises au MEBe nous ont également guidés sur la répartition des virions autour des billes magnétiques ainsi que sur la quantité d’amas potentiellement présents à la fin de la préparation.
Ainsi, nous pouvons dire que l’observation d’agrégats de particules virales, bien que très petites, est possible au microscope multiphoton. Ainsi, à partir des observations présentées dans cet article, nous pouvons extraire trois types d’informations. La 1ère est que la microscopie multiphotonique permet d’observer des particules virales libres grâce aux agglomérats, ici provoqués par l’utilisation de particules magnétiques. Cependant, il n’est pas aisé de détecter les particules de façon individuelles lorsqu’elles sont en dehors de l’agglomérat. La 2nde information est que, bien que la résolution soit meilleure au MEBe, cette solution ne permet que d’observer surface des amas en 2D alors que la microscopie multiphoton nous permet d’observer l’échantillon dans le volume. La 3ème information donnée par ces résultats est que le marquage des particules virales libres n’est pas indispensable pour l’imagerie de virions. La composition chimique complexe de tels objets biologiques (nombreuses protéines diverses) laisse pense que la structure présente suffisamment d’électrons délocalisables pour permettre de provoquer un mécanisme de fluorescence qui est alors endogène.
Pour aller plus loin, l’introduction de solutions numériques semble indispensable pour pouvoir exploiter ces résultats en contexte biologique. En effet, la question des moyens d’action du virus en situation d’infection reste posée.