Jeu de rôle et simulation d’une entreprise ou comment former les futurs professionnels de l’industrie pharmaceutique Role-play and business simulation or how to train future professionals in the pharmaceutical industry
La mise sur le marché d’un nouveau médicament fait intervenir des spécialistes de diverses disciplines. Les futurs professionnels de l’industrie pharmaceutique doivent non seulement acquérir des connaissances scientifiques variées afin d’être capables d’intégrer l’ensemble des problématiques, mais ils doivent également développer leurs compétences personnelles afin de savoir gérer efficacement les projets qui leur seront confiés. La démarche pédagogique mise en œuvre à la faculté de pharmacie de Limoges consiste à mettre les étudiants en situation d’apprentissage actif sous forme de jeu de rôle. Disposant de 500 g de principe actif, chaque groupe d’étudiants doit mettre au point et produire un lot de comprimés, et développer les contrôles pharmacotechniques et analytiques appropriés. Ce projet conduit les étudiants à s’organiser sous la forme d’une entreprise pharmaceutique virtuelle qui vise à déposer une demande d’Autorisation de Mise sur le Marché pour les différents comprimés élaborés. Finalement, un audit réalisé par des étudiants de Master 2 Management de la Qualité, permet d’avoir un regard extérieur sur le travail effectué et de compléter la démarche par une approche technico-réglementaire et qualité.
Bringing a new drug to market involves specialists from various disciplines. Future professionals in the pharmaceutical industry must not only acquire a variety of scientific knowledge in order to be able to integrate all the issues, but they must also develop their personal skills in order to know how to effectively manage the projects entrusted to them. The educational approach implemented at the Faculty of Pharmacy of Limoges consists of putting students in an active learning situation in the form of role play. With 500 g of active ingredient, each group of students must develop and produce a batch of tablets, and develop the appropriate analytical controls. This project leads the students to organize themselves in the form of a virtual pharmaceutical company which aims to file a request for Marketing Authorization for the various tablets developed. Finally, an audit carried out by Master 2 Quality Management students provides an outside perspective on the work carried out and completes the process with a technical-regulatory and quality approach.
Introduction
Les étapes qui mènent à la mise sur le marché d’un nouveau médicament sont nombreuses, longues, couteuses et font intervenir des spécialistes de diverses disciplines (chimie organique, pharmacologie, pharmacie galénique, chimie analytique, pharmacognosie …). Les futurs professionnels destinés à travailler dans l’industrie pharmaceutique doivent non seulement acquérir des connaissances dans chacun de ces domaines afin d’être capables d’intégrer l’ensemble des problématiques, mais ils doivent également développer leurs compétences personnelles (communication, travail en mode projet, prise de décision, autonomie, sens de l’organisation…) afin de savoir gérer efficacement les projets qui leur seront confiés. La démarche pédagogique mise en œuvre à la faculté de pharmacie consiste à mettre les étudiants en situation d’apprentissage actif, avec des enseignements pratiques sous forme de projets.
Au fur et à mesure du cursus de formation dans la filière industrie, les travaux confiés aux étudiants vont leur demander une autonomie et une organisation croissantes, afin de les amener progressivement à un fonctionnement le plus professionnel possible.
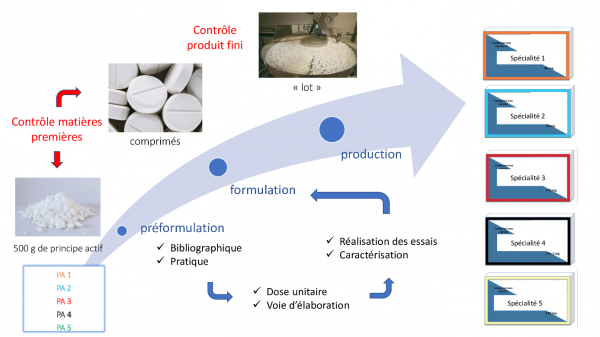
L’exemple présenté ici concerne les étudiants de 5ème année de pharmacie. Il vise à développer leurs compétences dans le domaine du développement galénique et analytique du médicament mais également à renforcer leurs connaissances en qualité et affaires réglementaires. Ce projet se déroule en 3 temps : mise au point et production du médicament, contrôle des matières premières et produits finis, et mise en forme de l’ensemble des données dans un document électronique reprenant la structure du module 3 du e-CTD (dossier technique à fournir pour toute demande de mise sur le marché d’une spécialité pharmaceutique). L’aboutissement de ce projet est la création d’une entreprise pharmaceutique virtuelle qui sera soumise à un audit réalisé par des étudiants inscrits en M2 Management de la Qualité.
1. Mise au point et production du médicament
Les formes solides et en particulier les comprimés, sont les médicaments les plus largement présents sur le marché. Néanmoins leur mise au point et la production à grande échelle restent complexes c’est pourquoi l’objectif fixé aux étudiants est de développer une formule de comprimés contenant un principe actif imposé.
La promotion est répartie en groupes de 4 à 5 étudiants. Chaque groupe se voit affecté un principe actif et dispose de 500 g de produit pour réaliser tous les essais nécessaires.
La démarche s’effectue en 3 étapes (voir Figure 1) : préformulation, formulation et production.
Figure 1 : les différentes étapes de mise au point, fabrication et contrôle du médicament)
1.1. Préformulation
Le travail de préformulation consiste à acquérir le maximum d’informations sur le principe actif afin de préciser les caractéristiques des comprimés à développer : dose unitaire, posologie, modalités de prise, patients visés… Les étudiants commencent donc le projet par une recherche bibliographique et une caractérisation des propriétés du principe actif.
1.1.1. Recherche bibliographique
La recherche bibliographique doit permettre aux étudiants de recueillir toutes les données disponibles sur le principe actif [1, 2, 3, 4]. Ces informations concernent à la fois les propriétés physico-chimiques du produit (solubilités dans les principaux solvants, aspect, stabilité à la température et à l’humidité, incompatibilités…) et les données biopharmaceutiques (demi-vie, site d’action, concentration thérapeutique, biodisponibilité…). Cette première étape sensibilise les étudiants à l’importance de la communication entre les différents interlocuteurs impliqués dans le développement du médicament : dans un cadre industriel, les chercheurs ayant obtenu la nouvelle molécule et les pharmacologues ayant réalisé les premières évaluations transmettent les informations à l’équipe en charge du développement galénique afin d’orienter au mieux la mise au point du médicament.
1.1.2. Caractérisation du principe actif
En complément des données bibliographiques, chaque principe actif doit faire l’objet de caractérisations pharmacotechniques afin de connaitre précisément les propriétés du produit mis à disposition des étudiants. Concrètement, dans le cadre du développement d’une formule de comprimés, une évaluation des propriétés d’écoulement, de densification et de cohésion sera réalisée afin d’identifier les qualités mais également les « défauts » du principe actif.
Les différents groupes ont à disposition le matériel leur permettant de réaliser ces caractérisations et s’organisent pour planifier l’enchainement des essais et la mutualisation de protocoles opératoires, afin d’harmoniser la progression de chaque équipe.
A l’issue de ce travail de préformulation, une séance d’échange avec les encadrants permet de définir les caractéristiques des comprimés à fabriquer (dose unitaire en principe actif, voie de fabrication et excipients).
1.2. Formulation
Cette 2ème étape consiste à réaliser les essais qui vont permettre de transformer le principe actif en comprimé parfaitement dosé en substance thérapeutique. Les étudiants font évoluer leur formule (choix des excipients et quantités) en fonction des problématiques rencontrées : écoulement insuffisant, problème de collage ou de désagrégation… La démarche doit êre structurée pour ne pas gaspiller du principe actif inutilement, tout en obtenant des données suffisamment fiables pour orienter efficacement la formulation et pouvoir justifier la formule finale.
Lorsqu’une formule répondant aux spécifications est obtenue, le projet évolue vers la phase de production.
1.3. Production
Cette phase de production consiste à fabriquer les comprimés à une échelle plus importante. En fonction de la quantité de principe actif disponible à l’issue des essais de formulation, les étudiants reproduisent la formule retenue en augmentant les volumes de matières manipulées. Cette démarche leur permet d’être sensibilisés à la transposition industrielle (scale up) même si le changement d’échelle reste limité.
Le lot de comprimés obtenu est soumis à un contrôle qualité permettant la libération du lot si l’ensemble des résultats est conforme aux spécifications.
2. Contrôle analytique des matières premières et du lot de comprimés
Dans l’industrie pharmaceutique, aucune matière première ne peut être utilisée sans avoir été contrôlée au préalable [5]. Chaque principe actif est donc contrôlé ainsi que les principaux excipients utilisés. Si la matière première est inscrite à la Pharmacopée Européenne [4], le contrôle est réalisé en suivant la monographie correspondante ; s’il n’y a pas de monographie, les étudiants doivent mettre au point la technique et s’il n’est pas possible de réaliser l’analyse (faute de temps ou de matériel adapté) alors c’est le bulletin de contrôle du fournisseur de la matière première qui justifie de la qualité du produit.
Il est également indispensable de s’assurer de la qualité de chaque lot de comprimés. Des prélèvements sont donc réalisés et soumis à des contrôles dont les résultats seront comparés à des spécifications et reportés dans les dossiers de lot.
Si l’ensemble des résultats des contrôles réalisés sur les matières premières et sur le lot de produit fini est conforme aux spécifications, alors le lot de comprimés est déclaré conforme et peut être libéré. En France, cette décision d’autoriser la sortie du lot de médicaments de l’usine de fabrication pour intégrer le circuit de distribution, est prise par le pharmacien responsable qui engage sa responsabilité.
3. Mise en forme des données (rédaction du e-CTD) et audit qualité
Afin de familiariser les étudiants avec la structure du document e-CTD qui permet la demande d’Autorisation de Mise sur le Marché d’un nouveau médicament, il est demandé à l’ensemble de la promotion de s’organiser pour présenter l’ensemble de leurs données dans un fichier excel commun. Ils doivent identifier les éléments devant figurer dans le dossier pour soutenir la demande d’AMM (justification de la formule et des contrôles, spécifications, responsabilités…). Ils doivent également gérer les liens qui permettent de naviguer facilement dans le document pour trouver les informations (procédures, qualification des appareils…).
Chaque étudiant se positionne à un poste dans l’organigramme de l’entreprise et doit s’assurer de la qualité des données dont il a la responsabilité.
L’aboutissement du projet est la séance d’audit réalisée avec les étudiants de M2 management de la qualité. Le document électronique est transmis aux futurs professionnels en management de la qualité quelques jours avant l’audit ce qui leur permet de prendre connaissance du contenu et de préparer des questions. L’audit se déroule en visioconférence. Elle débute par une réunion d’ouverture permettant d’expliquer le déroulement de l’audit puis les échanges entre les deux promotions se déroulent sur 3h environ. Les étudiant de P5 industrie doivent réagir et s’organiser pour répondre rapidement aux questions des auditeurs, comme dans une situation d’audit réel. Cet exercice permet aux étudiants de se rendre compte de la précision des données qui sont requises et de la profondeur des investigations menées lors d’un audit. Ils apprennent à construire leur argumentation et à apporter les données pour étayer leurs choix.
Conclusion
Ce projet, à la fois concret et virtuel, est ambitieux : il place les étudiants au cœur de la démarche pédagogique en leur fixant un objectif mais en leur laissant beaucoup d’autonomie pour l’atteindre. Cette liberté encadrée plait aux étudiants ; ils apprécient la confiance et la disponibilité de l’équipe enseignante, et la possibilité de prendre des décisions. Ils sont formés à la prise de responsabilités et à l’engagement, ce qui est attendu de la part de tous les cadres de l’industrie pharmaceutique, et en particulier les pharmaciens responsables.
La rédaction d’un rapport écrit (en complément du e-CTD) ainsi que la présentation orale à la fin du projet, leur permettent de développer leurs qualités en communication écrite et orale.
Enfin, l’exercice de l’audit et le regard extérieur d’étudiants qui n’ont pas suivi concrètement le projet, est très efficace pour leur faire prendre conscience du niveau de qualité de leur travail : un document e-CTD bien construit et complet amènera les auditeurs à des questions très pointues et à rechercher des détails.
En conlusion, cette démarche pégagogique demande aux étudiants beaucoup de travail personnel et d’engagement, mais elle leur permet de développer de nombreuses compétences professionnelles et personnelles.