Dans le département de la Haute-Vienne, deux espèces de limnées : Galba truncatula et Omphiscola glabra, sont connues pour être des hôtes intermédiaires dans le cycle de vie d’un parasite, Fasciola hepatica. Ces deux mollusques montrent, à l’heure actuelle, un déclin dans le nombre des populations et la superficie de leurs habitats. Pour expliquer ce déclin, le réchauffement climatique a été proposé comme l’un des facteurs possibles. Comme plusieurs épisodes de canicule ont eu lieu dans le département en 2015, 2018 et 2019, des investigations ont été effectuées en 2020 dans 190 prairies marécageuses pour dénombrer les populations de chaque espèce, les individus transhivernants de chaque population et préciser la superficie de leurs habitats. Si l’on ne tient pas compte du type d’habitat, le nombre global des populations en 2020 a diminué de 37,5 % chez G. truncatula et de 23,7 % chez O. glabra par rapport aux relevés effectués par notre équipe dans les mêmes prairies en 2013-2014. De même, la densité globale des individus transhivernants a présenté une diminution de 74,7 % chez G. truncatula et de 55,4 % chez O. glabra. L’ampleur de la chute pour ces deux paramètres a présenté des variations selon le type d’habitat. Par contre, les habitats de G. truncatula et la plupart des sites avec O. glabra n’ont pas montré de variation significative dans leur superficie entre les deux périodes d’étude. Entre 2013-2014 et 2020, 11 populations de G. truncatula et six d’O. glabra se sont déplacées vers l’aval sur le cours même des rigoles de drainage et parfois jusqu’au fossé principal. Sept habitats peuplés par les deux espèces de limnées ont également été observés dans les prairies étudiées en 2020 alors qu’il n’y en avait pas en 2013-2014. Ces changements dans l’écologie et la dynamique des deux espèces de limnées doivent être rapportés en grande partie à l’effet des épisodes de canicule qui ont eu lieu dans le département au cours des années passées.
In the French department of Haute Vienne, two lymnaeid species, i.e. Galba truncatula and Omphiscola glabra, are known to be intermediate hosts in the development cycle of the parasite Fasciola hepatica. These two snails currently show a decline in the number of their populations and area of their habitats. To explain this decline, global warming was proposed as one of the possible factors. As several heat waves took place in the department in 2015, 2018 and 2019, investigations were carried out in 2020 in 190 swampy meadows to count the populations of each species, the overwintering individuals in each population and to specify the area of their habitats. Compared to values recorded by our team on the same grasslands in 2013-2014, the overall number of populations in 2020 decreased by 37.5 % for G. truncatula and by 23.7 % for O. glabra. Similarly, the overall density of overwintering snails showed a decrease of 74.7 % for G. truncatula and 55.4 % for O. glabra. The magnitude of the decline for these two parameters varied according to habitat type. In contrast, G. truncatula habitats and most sites with O. glabra did not show any significant variation in their area between the two study periods. Between 2013-2014 and 2020, 11 populations of G. truncatula and six of O. glabra have moved downstream on the course of the drainage furrows and sometimes to the main ditch. Seven habitats populated by the two lymnaeid species were also observed in the meadows studied in 2020 when there was none in 2013-2014. These changes in the ecology and dynamics of lymnaeid populations must be partly related to the effect of heat waves that have occurred in the department in the past years.
Introduction
Le réchauffement climatique est un processus mondial que les météorologues avaient déjà signalé depuis le début du 20ème siècle. C’est l’augmentation des températures moyennes aussi bien dans les océans que dans l’atmosphère (Stocker et al., 2013 ; Short et al., 2017). D’après le Groupe d'experts Intergouvernemental sur l'évolution du Climat (GIEC), la principale cause du réchauffement climatique est due à l’activité humaine. En effet, celle-ci a largement contribué à l’augmentation des gaz à effet de serre tels que le dioxyde de carbone, le méthane ou l'oxyde nitreux dans l'atmosphère (Crowley, 2000 ; Rosenzweig et al., 2008). Les conséquences directes de ce changement ne sont pas difficiles à déterminer. Parmi celles-ci, citons des changements régionaux dans les précipitations, la survenue d’événements météorologiques extrêmes plus fréquents comme les vagues de chaleur, une élévation progressive du niveau de la mer ou l'expansion des déserts (Stocker et al., 2013). Dans les zones atlantiques de l’Europe, le réchauffement climatique se traduit par la survenue d’hivers plus doux, plus humides et de périodes caniculaires au cours de l’été (Taylor, 2009). Ce changement peut comprendre aussi de fortes précipitations sur de courtes périodes, ce qui entraîne des crues, et des périodes sèches avec des températures de l'air élevées et des taux d'évapotranspiration importants conduisant à la sécheresse (Hershkovitz et al., 2013). Par contre, les conséquences indirectes de ce réchauffement climatique ne sont pas aussi faciles à mettre en évidence (Short et al., 2017).
Le climat est connu pour son impact sur les maladies parasitaires qui touchent l’homme et les animaux. Aussi le réchauffement climatique est-il en mesure de réduire ou au contraire d’augmenter la prévalence et l’intensité de ces parasitoses dans le monde entier (Short et al., 2017). Parmi ces affections, la distomatose à Fasciola hepatica Linnaeus, 1758, encore appelée fasciolose, est fortement dépendante des conditions climatiques et en particulier de la température et de la pluviométrie (Ollerenshaw, 1959, 1971 ; Ollerenshaw et Smith, 1969). Plusieurs auteurs comme Poulin (2006), Mas-Coma et al. (2009a, b), Van Dijk et al. (2010), Lofty (2014) et Short et al. (2017) ont déjà rapporté les effets potentiels du réchauffement climatique sur les caractéristiques de cette maladie. Ce processus peut potentiellement limiter ou étendre les aires naturelles de répartition de F. hepatica et rendre habitables des régions du globe où les conditions climatiques ne permettaient pas la survie du parasite. L’augmentation de la température a aussi une incidence sur le cycle de vie du Digène, ce qui peut directement affecter la prévalence de la parasitose dans la zone considérée (Short et al., 2017). Dans les pays tempérés de l’Europe de l’ouest, la survenue d’hivers plus doux et plus humides permet à davantage de métacercaires (stades larvaires infestants libres) de survivre à l'hiver dans les pâturages (Taylor, 2009). Il en est de même pour les mollusques d’eau douce qui assurent le développement des formes larvaires de F. hepatica (Van Dijk et al., 2010). Ceci s’est traduit par une augmentation de la prévalence de la fasciolose (jusqu’à 12 fois) dans plusieurs États de l'Union Européenne au cours des dernières années (de Waal et al., 2007 ; Fox et al., 2011). Dans certaines régions du Royaume-Uni, la fasciolose sous sa forme aiguë a davantage été constatée chez les moutons au milieu de l'été et ceci depuis quelques années (de Waal et al., 2007 ; Fox et al., 2011).
Sur les sols acides du Limousin, deux limnées : Galba truncatula (O.F. Müller, 1774) et Omphiscola glabra (O.F. Müller, 1774), encore dénommée Lymnaea glabra, sont connues pour être, à des titres divers, des hôtes intermédiaires potentiels de F. hepatica (Dreyfuss et al., 2015 ; Vignoles et al., 2018). La Limnée épaulée, plus connue sous le nom de Limnée tronquée, est considérée par les auteurs comme le mollusque hôte principal du parasite dans l’Europe de l’ouest (Kozak et Wedrychowicz, 2010 ; Relf et al., 2011 ; Jones et al., 2015, 2017 ; Correa et al., 2017). Par contre, O. glabra n’est qu’un hôte intermédiaire secondaire dans la région considérée car la réussite de son infestation par F. hepatica nécessite souvent qu’il soit co-infesté par les miracidiums de ce Digène et ceux d’un autre parasite : Calicophoron daubneyi Dinnik, 1962 (Abrous et al., 1998, 1999, 2000). Dans les prairies marécageuses de la Haute-Vienne, les populations de G. truncatula colonisent souvent l’extrémité périphérique des rigoles de drainage superficiel, qu’il y ait ou non une source temporaire ou permanente, tandis que les colonies d’O. glabra se situent plus en aval sur le cours de ces mêmes rigoles (Vareille-Morel et al., 1999, 2007). Plusieurs études sur ces populations locales de limnées ont montré que leur nombre avait baissé de 34 % dans le cas de G. truncatula et de 23,4 % chez O. glabra au cours des trente dernières années (Dreyfuss et al., 2016a). Parmi les hypothèses que ces auteurs ont proposées pour expliquer ce déclin, le changement climatique a été retenu comme l’un des facteurs possibles.
D’après Cordellier et Pfenninger (2009) et Cordellier et al. (2012), le réchauffement climatique devrait modifier profondément les caractéristiques des habitats colonisés par les limnées. L'augmentation de l'évaporation, la baisse de la concentration en oxygène due à l'augmentation de la température de l'eau et aux changements dans le schéma des précipitations sont susceptibles d'affecter la survie et la reproduction de ces gastéropodes. En utilisant les données climatiques du nord-ouest de l’Europe, Cordellier et al. (2012) prévoient un changement profond dans la répartition des pulmonés d'eau douce dans les 60 années à venir. D’après ces auteurs, de nouvelles zones situées plus au nord seront colonisées par la plupart des 17 genres étudiés, y compris G. truncatula. Leurs habitats actuels subiront une réduction drastique de leur superficie et les aires restantes seront peuplées par des espèces plus méridionales. Les autres projections sur les effets futurs du réchauffement climatique sur la fasciolose (Mas-Coma et al., 2009 ; Fox et al., 2011 ; Halimi et al., 2015) ne tiennent pas compte, ou seulement en partie, du mollusque hôte. Dans les conditions du laboratoire, d’autres auteurs ont étudié les effets d’une élévation de température ou d’une canicule sur le comportement et la physiologie des Lymnaeidae : c’est le cas des recherches effectuées par Salo et al. (2017) et Leicht et al. (2017, 2019) sur Lymnaea stagnalis (Linnaeus, 1758). Malgré ces travaux intéressants, aucune étude à notre connaissance n’a encore été réalisée sur le terrain pour déterminer les effets d’un tel réchauffement sur les populations du mollusque hôte et les caractéristiques de ses habitats.
Comme plusieurs épisodes de canicule ont eu lieu en France en 2015, 2018 et 2019 (Huguen, 2019), il nous a paru intéressant de procéder à des investigations de terrain afin de déterminer les conséquences de ces épisodes sur les populations de G. truncatula et d’O. glabra dans la Haute-Vienne par le biais des quatre questions suivantes : les populations de chaque espèce ont-elles diminué en nombre en 2020 ? Leurs habitats sont-ils du même type ? La superficie de ces habitats a-t-elle diminué ? Quel est le nombre des adultes transhivernants ? Pour répondre à ces questions, une étude a été réalisée en 2020 dans les prairies marécageuses de 38 fermes situées dans le nord-ouest et l’ouest du département. Les résultats obtenus ont été comparés aux données que notre équipe avait déjà notées dans les mêmes exploitations lors d’une première enquête réalisée en 2013 et 2014 (Dreyfuss et al., 2016a).
Matériel et méthodes
2.1. Fermes étudiées
Trente-huit fermes élevant des bovins ou des ovins ont été sélectionnées pour cette étude pour les trois raisons suivantes : a) ces exploitations sont situées dans la même tranche altitudinale (entre 190 et 256 m) car la superficie des habitats occupés par G. truncatula et la densité des individus transhivernants chez les deux limnées présentent une diminution significative lorsque l’altitude moyenne des municipalités de la Haute-Vienne augmente (Dreyfuss et al., 2018a, b) ; b) elles sont localisées dans le nord-ouest (communes de Gajoubert, Nouic, Saint-Barbant, Saint-Martial-sur-Isop et Val-d’Issoire) et dans l’ouest du département (communes de Javerdat, Saint-Brice-sur-Vienne, Saint-Junien et Saint-Victurnien) si bien que leurs prairies sont soumises aux mêmes conditions par rapport aux vents humides qui viennent de l’Océan Atlantique ; c) les habitats peuplés par G. truncatula et ceux occupés par O. glabra y étaient en nombre assez important lors des investigations que notre équipe avait effectuées dans ces fermes en 2013 et 2014.
Le sous-sol de ces exploitations est granitique (20 cas) ou gneissique (18). Les 190 prairies permanentes incluses dans le périmètre de ces fermes sont de type hygro-mésophile avec une zone mésophile dominant en superficie sur l’autre zone. Un réseau de drainage superficiel, alimenté ou non par des sources temporaires sur la plus grande partie de l’année, est présent dans toutes ces pâtures (Fig. 2). Ce réseau n’est curé que tous les trois, quatre ou cinq années selon son état de dégradation. Toutes ces prairies sont soumises à un régime alterné de pâturage par les ruminants et de fauche au cours de l’été. Le pH de l’eau, qui circule dans les réseaux de drainage, y varie de 6,1 à 7, tandis que la concentration en ions calcium dissous est inférieure à 20 mg/L (Guy, 1996 ; Guy et al., 1996).
Le climat est de type continental, mais il est fortement modulé par les vents humides provenant de l’Océan Atlantique. La pluviométrie annuelle moyenne varie de 850 à 950 mm dans les fermes situées dans le nord-ouest du département alors qu’elle est comprise entre 900 et 1200 mm dans l’ouest de la Haute-Vienne. De la même façon, la température moyenne annuelle est supérieure à 11° C dans le nord-ouest et comprise entre 10,5° et 11° C dans l’ouest du département (Dreyfuss et al., 2016a, b).
2.2. Types d’habitats
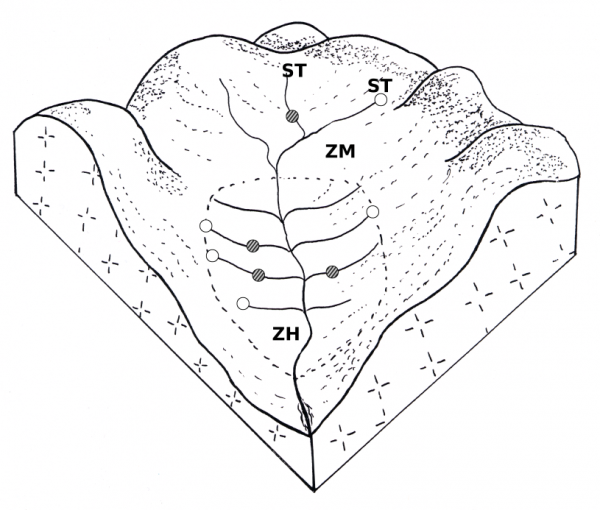
Figure 1 : Bloc-diagramme montrant la localisation des habitats colonisés par Galba truncatula (○) et Omphiscola glabra (●) sur le réseau de drainage superficiel dans une prairie marécageuse sur sol acide. Abréviations : ZH, zone hygrophile ; ZM, zone mésophile ; ST, source temporaire.
La figure 1 montre un exemple de réseau de drainage superficiel dans un bassin versant de la Haute-Vienne. Des rigoles sont creusées à intervalles réguliers dans la prairie pour que l’eau de ruissellement en excès s’écoule. Ces canaux s’ouvrent sur un fossé principal, lequel conduit le flot à un ruisseau, une rivière ou un étang. Plusieurs types d’habitats ont été définis par Vareille-Morel et al. (1999) pour G. truncatula : (i) l’extrémité périphérique d’une rigole dépourvue de source, (ii) le même type de site mais avec une source généralement temporaire qui s’y déverse, (iii) la jonchaie de pente située autour d’une source à flanc de colline lorsque le filet d’eau qui en provient ne s’écoule pas dans une rigole, (iv) le fossé principal de drainage, (v) une zone piétinée par les bovins ou les ovins lorsque les parois de la rigole proche ou du fossé principal sont détruites, (vi) les bords d’un étang, généralement à la queue du plan d’eau, et (vii) les berges d’un ruisseau ou d’une rivière. Dans le cas d’O. glabra, Vareille-Morel et al. (2007) retrouvent les mêmes types d’habitats, sauf pour les types (i) et (ii), car les populations de cette limnée colonisent le cours même des rigoles. Chez les deux espèces, la plupart des populations ont été observées dans les habitats de type (i), (ii) et (iii) (Rondelaud et al., 2011, 2017).
A l’extrémité périphérique des rigoles, le sédiment sableux ou vaseux est dépourvu de macrophytes et n’est recouvert que par des algues unicellulaires ou filamenteuses (s’il y a une source). Sur le cours même de ces rigoles, le sédiment se mélange à des débris organiques en quantité plus ou moins importante (jusqu’à 1 cm d’épaisseur). La couche de débris organiques est plus importante dans le fossé principal comme dans les jonchaies situées autour d’une source (jusqu’à 3 cm). Dans le cas des habitats le long des collections d’eau, le sédiment émergé est généralement caché par la végétation riveraine (bords d’étang) ou recouvert de pierres ou de débris organiques en quantité variable (berges de ruisseau).
Comme le type et la superficie des habitats peuplés par ces limnées peuvent aussi évoluer dans le temps ou l’espace en fonction des modifications que l’homme effectue dans ces prairies (Vareille et al., 1996), une recherche approfondie a également été réalisée dans chacune des 190 prairies afin de s’assurer que certaines populations initialement implantées dans un habitat n’aient pas été déplacées vers l’aval sous l’effet du courant ou d’un autre facteur.
2.3. Protocole des investigations
Des investigations ont déjà eu lieu en 2013 et en 2014 sur les 190 prairies pour identifier les populations des deux espèces de limnées et déterminer les caractéristiques de leurs habitats (Dreyfuss et al., 2016a). Ces pâtures ont été réexaminées en 2020 pour déterminer le nombre de populations présentes, mesurer la superficie de leurs habitats et décompter les individus. La première enquête a été effectuée en mars et en avril 2013 ou 2014. Par contre, la seconde a été réalisée en février et en mars 2020 en raison de la clémence des températures à cette époque. Ces périodes ont été sélectionnées pour les deux raisons suivantes : a) les habitats sont alors gorgés d'eau ; b) ils ne sont peuplés que par des adultes appartenant à la génération née au cours de l’automne précédent (individus transhivernants). Lorsqu’une population de limnées n’a pas été retrouvée en 2020 dans une prairie, l’éleveur a été interrogé pour connaître la cause éventuelle à l’origine de cette disparition.
Les adultes de taille supérieure à 4 mm chez G. truncatula et de 12 mm chez O. glabra ont été dénombrés par chasse à vue ou à l’aide d’une passoire (grandeur des mailles : 3 mm) selon la hauteur de l’eau. En 2013 et 2014, chaque décompte dans les habitats de type (i) à (v) a été effectué par deux personnes pendant 30 à 40 minutes, alors que sur les bords d’étang et les berges de ruisseau, chaque relevé a été réalisé par une seule personne pendant 15 à 20 minutes. Par contre, en 2020, les mêmes décomptes n’ont été effectués que par une seule personne à raison de 15 minutes par habitat (lorsqu’il y a une population). La superficie de chaque habitat a ensuite été déterminée. La mesure des zones occupées par G. truncatula ou O. glabra est facile dans le cas des rigoles de drainage en raison de leur largeur constante et parfois dans le fossé principal. Il en est de même pour les habitats situés sur les berges d’étang ou de ruisseau car les limnées sont généralement proches des bords. Lorsque la forme de l’habitat était irrégulière (ceux situés à l’extrémité d’une rigole, d’une source, ou sur une zone piétinée), la seule solution a été de procéder à une cartographie et à déterminer la superficie de ce dernier en fonction de sa forme et de ses dimensions.
Lorsqu’un habitat détecté en 2013 ou en 2014 a été observé plus en aval sur un autre segment du réseau de drainage, la distance entre le site initial et celui observé en 2020 a été mesurée. Si les deux espèces de limnées ont formé une communauté mixte (Dreyfuss et al., 2014), la superficie de la zone occupée par chaque espèce dans l’habitat commun ainsi que les individus correspondants ont été considérés séparément.
2.4. Paramètres étudiés
Le premier est le nombre de populations que notre équipe a constaté pour chaque espèce de limnées, chaque type d’habitat et chaque période d’investigations. Le tableau 1 répertorie ces valeurs et indique aussi la diminution numérique constatée entre 2013-2014 et 2020. Ces valeurs ont été comparées à l’aide du test exact de Fisher. De plus, la fonction Fisher.multcomp du package RVAideMemoire (R Core Team, 2016) a été employée comme test post-hoc afin d’effectuer des comparaisons par paires.
Les trois autres paramètres sont la superficie globale des habitats, la densité des limnées transhivernantes par m² d'habitat, et la distance qui existe entre l’habitat initial d’une population en 2013-2014 et celui observé en 2020 lorsque cette population s’est déplacée vers l’aval. Les valeurs individuelles obtenues pour les superficies ont été ramenées à une moyenne, encadrée d’un écart type, en tenant compte de l’espèce de la limnée et du type d’habitat. Un protocole identique a été également utilisé pour les densités. Les deux types de données ont d’abord été analysés à l'aide du test de normalité de Shapiro-Wilk (Shapiro et Wilk, 1965). Comme la distribution de ces valeurs n'était pas normale dans les trois cas, le test de Kruskal-Wallis a été utilisé pour établir les niveaux de signification statistique. Ces analyses ont été réalisées à l'aide du logiciel R x64 3.3.0 (R Core Team, 2016).
Comme plusieurs communautés mixtes avec les deux espèces de limnées ont été notées lors des investigations réalisées en 2020, la densité de chaque espèce a été présentée sous forme de graphes pour les deux types de rigoles de drainage.
La nomenclature utilisée pour les noms scientifiques et vernaculaires des mollusques ou des parasites est celle que le Muséum National d’Histoire Naturelle de Paris a adoptée pour la dénomination de ces différentes espèces animales (https://inpn.mnhn.fr/accueil/recherche-de-donnees/especes).
Résultats
3.1. Populations de limnées
Le nombre total des populations identifiées en 2013-2014 et en 2020 est fourni sur le tableau 1 pour chaque espèce de limnée. Par rapport aux relevés effectués en 2013-2014, le nombre global des populations en 2020 a chuté de 37,5 % pour G. truncatula et de 23,7 % pour O. glabra. L’examen du tableau par rapport aux types d’habitats permet de formuler deux autres remarques. Tout d’abord, la diminution du nombre des populations dans trois types d’habitats (rigoles dépourvues de source, rigoles avec source, jonchaies) est significativement plus grande (p < 5 % dans chaque cas) chez G. truncatula que chez O. glabra. Par contre, il n’y a pas de différence significative entre les valeurs relevées en 2013-2014 et en 2020 dans le cas des fossés de drainage, quelle que soit l’espèce de la limnée. Le faible nombre de valeurs dans les trois autres types d’habitats ne permet pas de dégager une tendance nette. La seconde remarque porte sur la variation qui existe dans les pourcentages entre les types d’habitats de chaque espèce. Dans les rigoles dépourvues de source, la diminution est plus grande que dans celles qui en possèdent une (G. truncatula : p < 0,1 % ; O. glabra : p < 1 %) ou dans les jonchaies (G. truncatula : p < 0,1 % ; O. glabra : p < 1 %). Par contre, il n’y a pas de différence nette entre les valeurs relevées dans les rigoles avec une source et les fossés de drainage, quelle que soit l’espèce de la limnée.
Tableau 1 : Distribution numérique des populations de Galba truncatula et d’Omphiscola glabra en 2013-2014 et en 2020 dans le nord-ouest et l’ouest de la Haute-Vienne. Les pourcentages correspondant à la diminution du nombre d’habitats entre les deux périodes d’investigations sont indiqués entre parenthèses.
|
Type d’habitat |
Nombre de populations (diminution en %) |
|||
|
Galba truncatula |
Omphiscola glabra |
|||
|
2013-2014 |
2020 |
2013-2014 |
2020 |
|
|
Rigoles sans source |
187 |
99 (47,1)* |
73 |
49 (32,9)* |
|
Rigoles avec source |
105 |
76 (27,7)* |
106 |
89 (16,1) |
|
Jonchaies avec source |
155 |
112 (27,8) |
75 |
64 (14,7) |
|
Fossés de drainage |
27 |
13 (51,9) |
21 |
15 (28,6) |
|
Zones piétinées |
5 |
1 (80,0) |
1 |
0 (100) |
|
Bords d’étang |
1 |
0 (100) |
6 |
1 (83,4) |
|
Berges de ruisseau |
3 |
1 (66,6) |
6 |
2 (66,8) |
|
Totaux |
483 |
302 (37,5) |
288 |
220 (23,7) |
Depuis les relevés de 2013-2014, des populations se sont déplacées vers l’aval du réseau de drainage (Tableau 3). Onze populations de G. truncatula ont ainsi été observées en 2020 sur le cours même des rigoles ou sur le fossé principal, alors qu’elles occupaient l’extrémité périphérique des dites rigoles en 2013-2014. De même, six colonies d’O. glabra ont été retrouvées en 2020 à l’extrémité aval de ces rigoles ou sur le fossé principal. La distance relevée entre les habitats de 2013-2014 et ceux de 2020 se distribue entre 5 et 24 m pour G. truncatula, et entre 4 et 18 m pour O. glabra (Tableau 2).
Tableau 2 : Etat récapitulatif des 17 populations qui se sont déplacées vers l’aval du réseau de drainage, avec indication de la distance entre l’habitat de 2013-2014 et celui de 2020 ainsi que du nombre de populations concernées. a, extrémité amont de la rigole ; b, zone médiane.
|
Espèce de la limnée |
Déplacement d’une population vers l’aval |
Nombre |
||
|
Habitat en 2013-2014 |
Habitat en 2020 |
Distance (m)* |
||
|
Galba truncatula |
Rigole sans sourcea |
Sur la même rigole |
5-11 |
5 |
|
Sur le fossé |
15-24 |
2 |
||
|
Rigole avec sourcea |
Sur la même rigole |
7-16 |
4 |
|
|
Omphiscola glabra |
Rigole sans sourceb |
Ouverture sur le fossé |
5-9 |
4 |
|
Sur le fossé |
13-18 |
2 |
||
* Valeurs minimale et maximale.
3.2. Superficie des habitats
Le tableau 3 présente les valeurs que notre équipe a notées lors des deux périodes d’investigation. En 2013-2014, la superficie moyenne des sites colonisés par G. truncatula variait de 1,3 à 6,5 m² selon le type d’habitat, d’où une moyenne globale de 1,5 m². Les chiffres relevés en 2020 ne présentaient guère de variation avec des valeurs moyennes allant de 1,1 à 2,2 m² selon le type d’habitat et une moyenne globale de 1,5 m². Aucune différence significative entre les superficies moyennes relevées en 2013-2014 et en 2020 n’a été notée, quel que soit le type d’habitat. Par rapport aux valeurs relevées pour la Limnée épaulée, la superficie des sites peuplés par O. glabra était plus grande en 2013-2014, avec des moyennes allant de 2,5 à 8,4 m² selon le type d’habitat et une moyenne globale de 6,5 m². En 2020, les superficies moyennes selon le type d’habitat étaient plus faibles : de 1,9 à 6,1 m² si bien que la moyenne globale n’a été que de 4,8 m². Des différences significatives entre les superficies moyennes relevées en 2013-2014 et en 2020 n’ont été notées que pour les habitats situés dans les rigoles dépourvues de source (H = 19,61 ; p < 0,1 %) et les fossés de drainage (H = 8,02, p < 1 %).
Tableau 3 : Superficie des habitats occupés par Galba truncatula et Omphiscola glabra dans 190 prairies marécageuses situées dans le nord-ouest et l’ouest de la Haute-Vienne. Les moyennes sont fournies avec leurs écarts types.
|
Type d’habitat |
Superficie des habitats (m²) : moyenne ± écart type |
|||
|
Galba truncatula |
Omphiscola glabra |
|||
|
2013-2014 |
2020 |
2013-2014 |
2020 |
|
|
Rigoles sans source |
1,3 ± 0,4 |
1,1 ± 0,5 |
6,3 ± 2,2 |
3,1 ± 1,3 |
|
Rigoles avec source |
1,9 ± 0,8 |
2,2 ± 0,9 |
8,4 ± 3,4 |
6,1 ± 3,2 |
|
Jonchaies avec source |
1,4 ± 0,5 |
1,5 ± 0,4 |
5,3 ± 1,7 |
4,7 ± 1,8 |
|
Fossés de drainage |
1,3 ± 0,7 |
1,1 ± 0,8 |
3,2 ± 1,3 |
2,1 ± 0,9 |
|
Zones piétinées |
6,3 ± 2,4 |
3,5 |
3,0 |
0 |
|
Bords d’étang |
3,1 |
0 |
2,5 ± 0,9 |
1,9 |
|
Berges de ruisseau |
5,5 ± 2,0 |
2,4 |
7,3 ± 3,5 |
4,3 ± 1,1 |
|
Totaux |
1,5 ± 1,0 |
1,5 ± 0,7 |
6,5 ± 2,7 |
4,8 ± 2,3 |
3.3. Densité des limnées transhivernantes
Les valeurs relevées en 2013-2014 et en 2020 sont fournies sur les tableaux 4 et 5. Si l’on ne tient pas compte du type d’habitat, le nombre des individus dans les populations dénombrées en 2020 a diminué de 74,7 % pour G. truncatula et de 55,4 % pour O. glabra par rapport aux relevés effectués en 2013-2014. Par contre, l’ampleur de ce déclin varie selon le type d’habitat. Dans le cas de la Limnée épaulée, la diminution numérique est plus élevée dans le cas des fossés de drainage (90,9 %) et des rigoles dépourvues de source (86,9 %) que dans les rigoles avec une source (74,4 %) et les jonchaies (44,3 %). Les pourcentages sont nettement plus faibles dans le cas d’O. glabra : 72,2 % dans les rigoles dépourvues de source, 56,5 % dans celles qui en possèdent une, 34,5 % dans les fossés de drainage et seulement 28 % dans les jonchaies. Les différences entre les densités de G. truncatula relevées au cours des deux périodes d’investigation sont significatives pour les rigoles avec une source (H = 35,04 ; p < 0,1 %), celles qui n’en ont pas (H = 29,71 ; p < 0,1 %), les jonchaies (H = 7,36 ; p < 1 %) et les fossés de drainage (H = 18,56 ; p < 0,1 %). Par contre, il n’y a pas de différence nette dans le cas des trois autres types d’habitats. Dans le cas d’O. glabra, les différences entre les valeurs sont significatives pour les populations vivant dans les rigoles avec une source (H = 19,54 ; p < 0,1 %), dans celles qui n’en ont pas (H = 13,47 ; p < 0,1 %) ainsi que sur les berges de ruisseau (H = 8,25 ; p < 1 %). Par contre, aucune différence nette n’a été notée dans le cas des jonchaies et des fossés de drainage.
Tableau 4 : Densité des Galba truncatula transhivernants dans 190 prairies marécageuses situées dans le nord-ouest et l’ouest de la Haute-Vienne. Les moyennes sont indiquées avec leurs écarts types.
|
Type d’habitat |
Densité de Galba truncatula par mètre carré d’habitat : moyenne ± écart type |
||
|
2013-2014 |
2020 |
Déclin ( %) |
|
|
Rigoles sans source |
24,4 ± 8,7 |
3,2 ± 1,5 |
86,9 |
|
Rigoles avec source |
29,6 ± 11,1 |
7,3 ± 2,9 |
75,4 |
|
Jonchaies avec source |
11,3 ± 4,2 |
6,3 ± 2,5 |
44,3 |
|
Fossés de drainage |
14,2 ± 5,1 |
1,3 ± 0,9 |
90,9 |
|
Zones piétinées |
2,1 ± 0,6 |
0,6 |
71,5 |
|
Bords d’étang |
13,2 |
0 |
100 |
|
Berges de ruisseau |
4,3 ± 0,9 |
4,2 |
2,4 |
|
Totaux |
20,5 ± 7,2 |
5,2 ± 2,1 |
74,7 |
Tableau 5 : Densité des Omphiscola glabra transhivernants dans 190 prairies marécageuses situées dans le nord-ouest et l’ouest de la Haute-Vienne. Les moyennes sont indiquées avec leurs écarts types.
|
Type d’habitat |
Densité d’Omphiscola glabra par mètre carré d’habitat : moyenne ± écart type |
||
|
2013-2014 |
2020 |
Déclin ( %) |
|
|
Rigoles sans source |
6,1 ± 1,5 |
1,7 ± 1,1 |
72,2 |
|
Rigoles avec source |
8,5 ± 2,1 |
3,7 ± 1,9 |
56,5 |
|
Jonchaies avec source |
2,5 ± 0,9 |
1,8 ± 0,9 |
28,0 |
|
Fossés de drainage |
2,9 ± 1,2 |
1,9 ± 1,0 |
34,5 |
|
Zones piétinées |
0,6 |
0 |
100 |
|
Bords d’étang |
1,7 ± 0,7 |
0,6 |
64,8 |
|
Berges de ruisseau |
5,2 ± 1,9 |
2,2 ± 1,5 |
57,7 |
|
Totaux |
5,6 ± 1,8 |
2,5 ± 1,1 |
55,4 |
3.4. Communautés mixtes
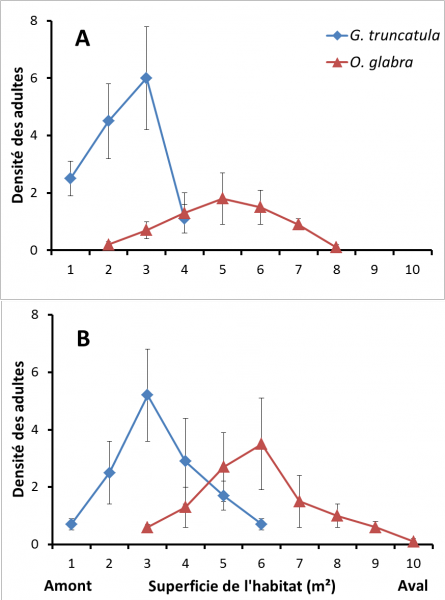
Figure 2 : Densités de Galba truncatula et d’Omphiscola glabra par rapport à la superficie de l’habitat commun, exprimée sous forme d’aires de 1 m² chacune, en allant de l'amont vers l'aval : rigoles dépourvues de sources (2A) et rigoles alimentées par des sources (2B). Les valeurs proviennent de relevés effectués en 2020 dans sept habitats peuplés par une communauté mixte. Les moyennes sont indiquées avec leurs écarts types.
Sept communautés mixtes formées par les deux espèces de limnées ont été observées en 2020 dans quatre rigoles dépourvues de source et dans trois autres qui en possèdent une. La figure 2 montre la distribution de G. truncatula et d’O. glabra dans les sept habitats colonisés par les deux espèces. Trois aires peuvent être reconnues dans chaque habitat : une zone amont peuplée par la Limnée épaulée, une zone de chevauchement où les individus des deux espèces sont présents, et une zone aval avec les seuls O. glabra. Dans les rigoles dépourvues de source (Fig. 2a), la zone colonisée par G. truncatula s’étend sur 4 m² et la densité de la population présente un pic dans la zone de chevauchement. Par contre, la superficie de la zone avec O. glabra est de 8 m² et le pic se situe dans la zone peuplée seulement par cette espèce. Dans les rigoles alimentées par des sources (Fig. 2b), les superficies occupées par chaque espèce sont plus importantes (6 m² pour G. truncatula, 8 m² pour O. glabra) et les pics dans les densités se situent à l’extrémité amont de la zone de chevauchement (G. truncatula) ou à l’extrémité aval de celle-ci (O. glabra).
4. Discussion
A l’heure actuelle, il est difficile de prévoir les modifications qui se produiront dans l’avenir au niveau des habitats et de la dynamique des deux espèces de limnées qui interviennent comme mollusques hôtes dans le cycle local de F. hepatica. Les résultats des études, que notre équipe a effectuées sur les populations de G. truncatula dans des régions à climat semi-aride ou aride comme l’Algérie (Mekroud et al., 2002, 2004), le Maroc (Moukrim et Rondelaud, 1991, 1992 ; Goumghar et al., 2001a, b ; Belfaiza et al., 2008, 2009) ou la Tunisie (Ayadi et al., 1993 ; Diawara et al., 2003), ne peuvent pas être transposés entièrement à la région du Limousin en raison des remarques que Woodward et al. (2010) ont formulées pour les collections d’eau face au changement climatique : a) de nombreuses espèces comme les limnées dans ces habitats fragmentés ont des capacités limitées pour se disperser au fur et à mesure que l'environnement change, b) la température et la disponibilité de l'eau dépendent du climat local, et c) de nombreux facteurs anthropiques de stress ont déjà un effet sur ces collections d’eau. Il en résulte que les changements à venir dans la dynamique des précipitations, de l'évaporation et des inondations entraîneront des modifications dans le niveau de l’eau, la structure des habitats où vivent les limnées et les temps de séjour que ces mollusques effectueront dans les zones humides (Heino et al., 2009 ; Domisch et al., 2011 ; Hershkovitz et al., 2013). Dans ces conditions, les données de la présente étude ne constituent qu’une première approche du problème et nécessitent d’être complétées au cours d’investigations ultérieures sur les mêmes prairies afin de pouvoir généraliser l’impact de ce changement climatique dans les prairies sur sols acides, soumises à un climat tempéré.
Par rapport aux relevés de 2013-2014, la diminution numérique des populations constatée en 2020 est significativement plus importante chez G. truncatula que chez O. glabra. Elle est aussi plus marquée lorsque l’habitat des limnées n’est pas alimenté par une source (Tableau 1). Deux faits peuvent expliquer ces résultats : a) la Limnée épaulée est connue pour son amphibiose si bien qu’elle peut vivre sur des terrains émergés humides au printemps, alors que l’autre espèce est nettement plus aquatique et ne sort rarement d’un point d’eau lorsque les conditions de vie sont favorables (Dreyfuss et al., 2015 ; Vignoles et al., 2018) ; b) dans les prairies marécageuses de la Haute-Vienne, seuls les juvéniles de G. truncatula, mesurant moins de 2 mm en hauteur, peuvent s’enterrer dans le sédiment lors de l’estivation des habitats (Rondelaud et Morel-Vareille, 1975) alors que les O. glabra sont capables de s’enterrer, quelle que soit leur taille, lors de la même période sous réserve qu’il y ait un sédiment sablo-vaseux assez épais, mêlé ou non à des débris organiques, sur le fond de leur habitat (Rondelaud et al., 2003). De plus, le développement de la végétation riveraine, qui entoure les habitats de ces limnées, a aussi un effet positif sur la survie des populations lors des périodes de canicule : elle est alors assez haute et dense autour des habitats d’O. glabra au cours de l’été alors que son développement est plus limité et la densité des macrophytes nettement plus faible autour des sites colonisés par la Limnée épaulée (D. Rondelaud, 2020, observation personnelle). Le déplacement de 17 populations de limnées vers l’aval de réseau entre les deux périodes d’investigation (Tableau 2) est nettement plus difficile à commenter car la littérature ne fournit pas de donnée sur les raisons d’un tel transfert. L’une des explications est d’invoquer un déplacement forcé de chaque population vers l’aval sous l’effet d’une crue provoquée par un excès d’eaux de ruissellement. Cependant, cette hypothèse cadre mal avec les exigences écologiques de chaque espèce, car G. truncatula comme O. glabra sont capables de remonter en hiver et au printemps la rigole à contre-courant jusqu’à l’extrémité périphérique de celle-ci, qu’il y ait ou non une source à son extrémité (Rondelaud, 1983 ; Rondelaud et al., 2005). Comme aucune limnée en train de migrer sur la longueur de rigole entre chaque habitat initial et celui observé en 2020 n’a été notée au cours de nos investigations, ce résultat nous conduit à supposer que chaque population se serait déplacé volontairement vers l’aval pour fuir un habitat devenu insalubre en raison des canicules successives et coloniser un nouveau site plus compatible avec la vie de chaque espèce.
La superficie moyenne des habitats peuplés par G. truncatula n’a pas présenté de variation significative entre les deux périodes d’étude (Tableau 3) et cela peut s’expliquer en partie par le fait que la plupart de ces sites sont de petite taille sur les sols acides du Limousin (Rondelaud et al., 2009, 2011). Dans le cas d’O. glabra, la diminution de la superficie n’est significative que dans le cas de deux types d’habitats, à savoir les rigoles dépourvues de source et les fossés de drainage, alors qu’il n’y a pas de différence nette pour les autres types d’habitats. Deux hypothèses peut-être complémentaires peuvent être proposées pour expliquer ce dernier résultat. La première est liée à la présence ou à l’absence d’une source temporaire. La présence de celle-ci dans des rigoles et les jonchaies maintiendrait une certaine humidité dans le sol de ces habitats au cours de l’estivation, ce qui favoriserait l’enfouissement des limnées (lorsque celui-ci se produit) et permettrait une meilleure survie des O. glabra sur toute la superficie de leur aire de distribution. La deuxième hypothèse se rapporte à la qualité et à l’abondance de la végétation riveraine autour des habitats situés dans les rigoles et les jonchaies avec une source. Celle-ci pourrait jouer un rôle dans le maintien des superficies colonisées par O. glabra dans ces deux types d’habitats.
Sur les sept types d’habitats considérés dans le nord-ouest et l’ouest de la Haute-Vienne, la densité des individus transhivernants en 2020 a présenté une diminution significative dans quatre types de sites pour G. truncatula et dans trois types pour O. glabra (Tableaux 4 et 5). Dans le cas de la Limnée épaulée, cette chute dans la densité des mollusques varie de 44,3 % (jonchaies avec source) à 90,9 % (fossés de drainage) alors qu’elle est de 56,5 % (rigoles avec source) et de 72,2 % (rigoles sans source) dans le cas d’O. glabra. Les résultats montrent a) que G. truncatula (espèce amphibie) est plus affecté par cette diminution numérique qu’O. glabra qui est plus aquatique, et b) que ce déclin dans le nombre des individus transhivernants est nettement plus important dans les habitats dépourvus de source que dans ceux qui en ont une. L’absence de différence significative entre les densités de G. truncatula sur les berges de ruisseau alors qu’elle l’est pour O. glabra peut s’expliquer par les nombreux abris (pierres, débris organiques) que la Limnée épaulée a à sa disposition sur les berges alors que l’autre espèce vit généralement dans le ruisseau même (généralement au niveau de l’herbier) et est ainsi plus impactée par les effets du réchauffement que l’autre espèce. De telles variations numériques pour G. truncatula et O. glabra au cours de l’année ont déjà été rapportées dans les prairies marécageuses sur sols acides (voir les revues de Dreyfuss et al., 2015 et de Vignoles et al., 2018). Ce qui est inhabituel dans la présente étude, c’est l’ampleur de la diminution numérique pour ces individus transhivernants dans certains types d’habitats. Ce résultat est en faveur d’un effet lié à la survenue d’un ou des épisodes successifs de canicule au cours des années passées dans la région. Les populations concernées par cette diminution numérique pourront certes se reconstituer si les conditions climatiques redeviennent favorables mais il faudra plusieurs années pour que chaque population retrouve sa taille initiale (Sabourin, 2018). L’évolution de ces populations dans le temps dépendra aussi de l’intensité du changement climatique en cours et de sa durée.
Les habitats avec une communauté mixte sont assez rares sur les sols acides de la Haute-Vienne lors des investigations que notre équipe a effectuées entre 1970 et 2006 (Rondelaud et al., 2014 ; Vignoles et al., 2018). Sept d’entre eux ont, par contre, été observés dans les prairies étudiées en 2020 alors qu’il n’y en avait pas dans ces pâtures lors de l’enquête réalisée en 2013 et 2014. La présence de tels sites avec les deux espèces de limnées en fonction de l’activité humaine ne peut être retenue pour expliquer leur formation car l’entretien des réseaux de drainage dans ces prairies est identique à celui appliqué dans les autres fermes étudiées. A notre avis, la formation de ces habitats avec une communauté mixte pourrait être une conséquence indirecte du réchauffement climatique car il y a eu, dans chaque cas, un déplacement des G. truncatula depuis leur habitat initial (l’extrémité amont de la rigole) vers la zone où vivaient les O. glabra. La distribution des individus de chaque espèce dans l’habitat commun est en accord avec les rapports d’Osenberg (1989) et de Cross et Benke (2002) sur d’autres collectivités de gastéropodes d’eau douce. Selon ces auteurs, il y a généralement une compétition pour la nourriture dans les sites colonisés par deux ou plusieurs espèces de gastéropodes, ce qui limite l’aire de distribution et la taille de chaque population.
Devant la diminution numérique des populations dans la Haute-Vienne et celle des individus chez un certain nombre d’entre elles, on peut se demander quelles seront les conséquences de ce processus sur la transmission de la fasciolose locale. La disparition de ces mollusques hôtes aura certes un effet direct sur la prévalence de la maladie animale. Mais il est possible que le parasite s’adapte rapidement à cette situation en utilisant des espèces de mollusques aquatiques ou terrestres qui ne sont pas des hôtes intermédiaires potentiels dans les conditions habituelles. C’est ainsi que d’autres espèces de Lymnaeidae comme Radix balthica (Linnaeus, 1758), Stagnicola fuscus (C. Pfeiffer, 1821) ou Stagnicola palustris (O.F. Müller, 1774) peuvent assurer le développement larvaire de F. hepatica à condition a) qu’elles soient infestées dans leurs premiers jours de vie (Boray, 1978 ; Caron et al., 2007, 2014 ; Novobilský et al., 2013) ou b) que l’infestation miracidienne s’effectue sur des juvéniles et des pré-adultes provenant de parents déjà infestés et ceci sur plusieurs générations successives (Rondelaud et al., 2014 ; Vignoles et al., 2016). De l’ADN de F. hepatica a également été détecté par des techniques de biologie moléculaire dans le corps d’Omalonyx matheroni (Potiez et Michaud, 1838) et dans celui de Succinea putris (Linnaeus, 1758) par plusieurs auteurs (Relf et al., 2009 ; Novobilský et al., 2014). Mais on ne peut dire, à l’heure actuelle, si ces succinées (mollusques terrestres hygrophiles) sont des hôtes intermédiaires potentiels de F. hepatica capables d’assurer le développement larvaire complet du parasite ou des mollusques non hôtes qui attirent les miracidiums de ce dernier par un effet « decoy » (effet leurre).
Conclusion
Le nombre des populations et l’abondance des individus transhivernants dans de nombreux habitats peuplés par G. truncatula ou par O. glabra présentent une diminution significative à l’heure actuelle. Dans la plupart des cas, il n’y a pas de variation significative dans la superficie des habitats par rapport aux valeurs relevées en 2013-2014. Par contre, des déplacements de populations vers l’aval du réseau de drainage ont été notés en 2020 avec la formation de plusieurs communautés mixtes partageant les mêmes habitats. Ces changements dans l’écologie et la dynamique des deux espèces sont dus en grande partie aux canicules qui ont eu lieu au cours des années passées. Si ces épisodes se reproduisent à nouveau dans les années à venir, d’autres investigations dans les mêmes prairies sont à prévoir afin de suivre les effets du réchauffement sur ces populations de mollusques et de modéliser, si possible, les conséquences de ce changement climatique sur les hôtes intermédiaires de F. hepatica sur les sols acides.