Diagnostics moléculaires de neuropathies d'origine génétique
Les patients suivis peuvent être diagnostiqués par méthode moléculaire (Séquençage NGS) dans le Service de Biochimie et Génétique Moléculaire du CHU de Limoges grace à la plateforme de Séquençage Genolim de l’UMS BISCEM, et de l’UF de Bioinformatique médicale qui a vue le jour au CHU de Limoges.
Variants de structure (SVs)
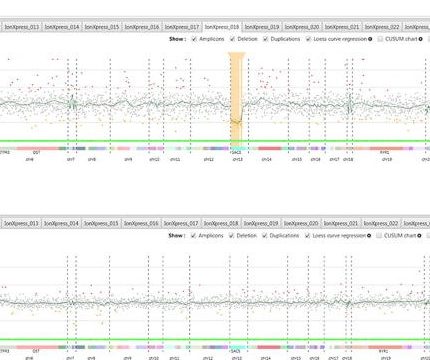
Une attention toute particulière a été portée sur l’identification et la caractérisation de Variants de structure (SVs) pathogènes responsables de la maladie de Charcot-Marie-Tooth (CMT), car environ 60% des patients n’ont pas de cause moléculaire identifiée pour leur pathologie.
Plus de 90 gènes sont identifiés à ce jour comme pouvant être responsables de la maladie de CMT, mais une forte proportion des patients testés ne sont pas diagnostiqués avec des mutations connues ou probables de ces gènes. Cependant, quelques Variants de Structure (SV), différents de la duplication de PMP22 ont été rapportés.
L’un des axes de recherche de l’équipe est donc d’identifier ces nouveaux SVs.Nous avons donc développé des outils bio-informatiques (logiciels publiés et disponible, Cov’Cop et CovCopCan) permettant de détecter des SVs à partir de donnés NGS.
Les résultats préliminaires, obtenus à partir de ces logiciels, suggèrent qu’il existe plusieurs SVs pathogènes responsable de la maladie de CMT. Les SVs recherchés seront des délétions, duplications, mais également d’éventuelles mosaïques, tout d’abord à partir des données NGS mais également par la suite l’étendre aux données obtenus à partir d’exomes.
Grâce à ces approches, de nouveaux SVs pourront être identifiés dans de nouveaux gènes d’intérêt, mais aussi identifier ces types de mutations actuellement sous-diagnostiquées et donc sous-estimées. Il a été établi qu’un tiers des patients qui présentent les signes cliniques de CMT, ne présentent pas les mutations qui sont actuellement décrites dans la littérature et reconnues pour induire la maladie.
L’identification de nouveaux gènes est un point important pour mieux comprendre la physiopathogénicité des CMT, mais aussi pour ne pas laisser les patients dans l’errance et l’absence de diagnostique.
Mutants d'épissage
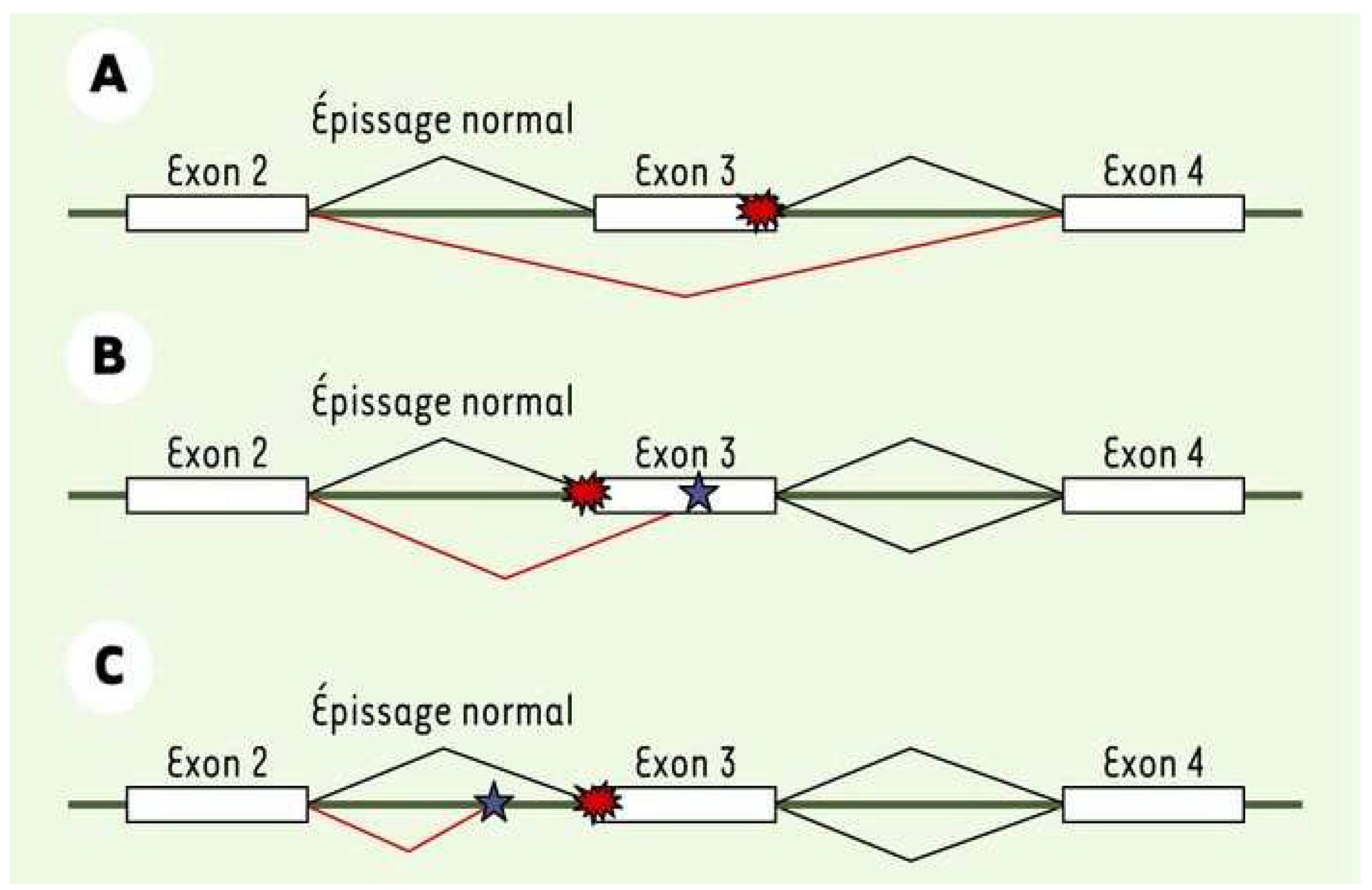
Une seconde attention a été portée sur les potentiels mutants d’épissage qui peuvent êtres observées dans les gènes impliqués dans la maladie de Charcot-Marie-Tooth (CMT) et les neuropathies périphériques. Nombreux sont prédits comme pouvant induire des anomalies d’épissage par différentes logiciels de prédiction. Ainsi, ces errueurs engendreraient un ARNm non conforme et donc une protéine modifiée.
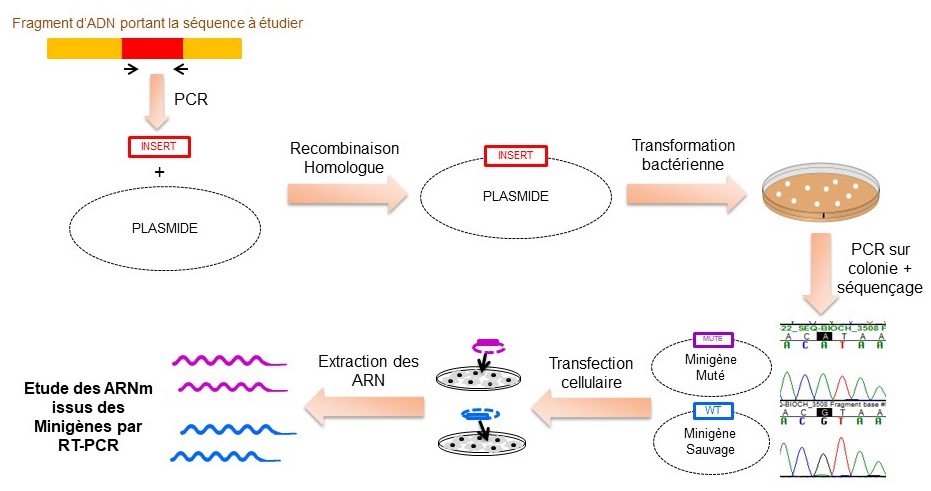
Afin de confirmer le potentiel pathogène de ces mutations, le proget « Minigène » a été mis en place afin d’étudier les effets de ces mutations sur l’épissage de l’ARNm en les créant in vitro. Cette étude se déroule en 2 étapes : (i) la création du « Minigène » contenant le fragment d’intérêt (sauvage et muté) par diffétentes techniques de biologie moléculaire, (ii) l’étude de l’effet des mutation sur l’épissage des ARNm du Minigène ainsi obtenu grâce à son utilisation en transfection cellulaire sur différentes lignées.
Quelques articles représentatifs
– The First Large Deletion of ATL3 Identified in a Patient Presenting with a Sensory Polyleuropathy. Pyromali et al. Biomedicines. 2023 May 28;11(6):1565. PMID: 37371660
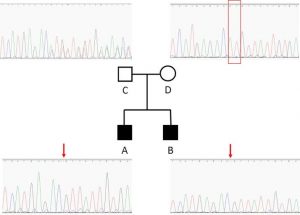
– From Negative to Positive Diagnosis: Strucutral Variation Could Be the Second Mutation You Are Looking for in a Recessive Autosomal Gene. Pyromali et al. J Pers Med. 2022 Feb 3;12(2):212. PMID: 35207700
– New structural variations responsible for Charcot-Marie-Tooth disease: The first two large KIF5A deletions detected by CovCopCan software. Pyromali et al. Comput Struct Biotechnol J. 2021 Jul 30;19:4565-4272. PMID: 34429846
– One multilocus genomic variation is responsible for a severe Charcot-Marie-Tooth axonal form. Miressi et al. Brain Sci. 2020 Dec 15;10(12):986. PMID: 33333791
– A mutation can hide another one: Think Structural Variants! Miressi et al. Comput Struct Biotechnol J. 2020 Aug 2;18:2095-2099. PMID: 32832037
– CovCopCan: An efficient tool to detect Copy Number Variation from amplicon sequencing data in inherited diseases and cancer. Derouault et al. PloS Comput Biol. 2020 Feb 12;16(2):e1007503. PMID: 32049956
– New PRPS1 variant p.(Met68Leu) located in the dimerization area identified in a French CMTX5 patient. Lerat et al. Mol Genet Genomic Med. 2019 Sep;7(9):e875. PMID: 31338985
– COV’COP allows to detect CNVs responsible for inherited diseases among amplicons sequencing data. Derouault et al. 2017 May 15;33(10):1586-1588. PMID: 28137711