Aspiration des pompes
Remarque :
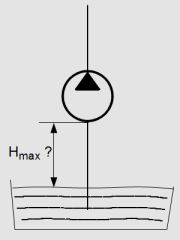
De quelle hauteur est-il possible de surélever une pompe au dessus du réservoir ?
Lorsque la pompe est entraînée par un moteur, la pression au sein de la pompe tend vers la pression absolue nulle (vide). C'est alors la pression atmosphérique qui s'applique sur le fluide du réservoir qui "pousse" le fluide dans la pompe.
Pour équilibrer une pression p=1 bar , il faut une colonne de fluide de hauteur h telle que p = ρ.g.h.
Avec un fluide de masse volumique ρ= 900 kg/m3 , cela correspond à une hauteur h ≈ 11 mètres.
Donc si la pompe est située au delà de 11 mètres, il sera impossible de l'amorcer. En pratique, cette hauteur avoisine plutôt 6 mètres.
Une solution souvent utilisée pour amorcer facilement une pompe est de l'utiliser immergée.
Remarque :
Si une pompe doit relever un fluide à une grande hauteur (exemple : 200m d'eau sur un ouvrage hydraulique), elle doit résister à la pression générée par la colonne d'eau. (soit 20 bars ici).
Quelle solution est-il possible de mettre en place pour limiter cette pression ?
Attention : phénomène de cavitation dans les pompes
La cavitation est provoquée par le dégazage et/ou la vaporisation d'un liquide lorsque la pression locale dans ce fluide diminue brutalement. Le gaz dissous dans le fluide provoque alors l'apparition de petites bulles. « En se formant ces bulles augmentent le volume de fluide présent dans la zone de basse pression ce qui à pour effet d'augmenter la pression en certains endroits où la bulle de gaz se condense violemment en implosant. »
Les chocs crées par l' éclatement des bulles détruisent les parois des organes en contact avec le fluide.
Ce phénomène est bien connu pour les hélices de bateau ou de sous-marin. L'implosion de ces bulles de gaz génère un bruit qui peut permettre de détecter un sous-marin et endommager les hélices.
Dans le cas de l'aspiration d'une huile hydraulique, ce phénomène apparaît à partir d'une dépression de 0,5 bar. Cela peut conduire à la dégradation irrémédiable d'une pompe en 20 minutes. Pour se prémunir de ce danger, il faut limiter la dépression à l'aspiration à :
ΔPaspiration < 0,2 bar.
Complément : La cavitation
La variation de la pression ou de la température influence le changement d'état d'un corps (passage de l'état liquide à l'état gazeux).
Prenons l'exemple de l'eau : en augmentant la température, des bulles de vapeur sont produites.
Au niveau de la mer, l'eau passe de l'état liquide à l'état gazeux à la température de 100°C. En altitude, le seuil d'ébullition de l'eau diminue du fait de la diminution de la pression atmosphérique. Il est donc possible de faire passer l'eau de l'état liquide à l'état gazeux à température constante si la pression baisse suffisamment.
Lorsque cette dépression est localisée, il y a «cavitation» s'il apparaît des poches d'air ou des bulles dans le milieu liquide. L'apparition de ces bulles gazeuses entraîne un ré-équilibrage des pressions par implosion.
