Recherche clinique
L’UF de recherche clinique en pharmacologie et toxicologie (RCPT), située dans le service de pharmacologie, toxicologie et pharmacovigilance du CHU de Limoges, est une structure support de l’UMR-1248 Pharmacologie & Transplantation.
Elle coordonne des études cliniques promues par le CHU de Limoges et l’INSERM, en étroite collaboration avec les autres UF du service (pharmacologie biologique et pharmacocinétique, de pharmacométrie et intelligence artificielle, et de toxicologie environnementale et santé au travail) et les services cliniques impliqués dans les projets (notamment, néphrologie, dialyse et transplantation et hépato-gastro-entérologie et nutrition). Ces études portent notamment sur les médicaments immunosuppresseurs, utilisés en transplantation ou dans d’autres pathologies telles que les maladies auto-immunes ou le cancer.

Caroline Monchaud
Responsable
L’UF RCPT aide les membres de l’UMR1248 dans la conception des projets de recherche clinique, en collaboration avec le promoteur, de l’idée de recherche à sa valorisation : recherches de financement, revue de la littérature, formulation des hypothèses de recherche, mise en conformité réglementaire, rédaction du protocole de recherche clinique, coordination des centres participants, gestion des échantillons biologiques, analyses de pharmacologie ou de toxicologie, data-management, analyses statistiques, modélisation pharmacocinétique, rédaction des rapports de fin d’étude, communications en congrès et publication dans des journaux scientifiques.
L’UF RCPT constitue et gère des collections biologiques en lien avec les thématiques de l’unité UMR1248. Elle est membre du CRBioLim (Centre de Ressources Biologiques du CHU de Limoges) et à ce titre, assure la conservation des ressources biologiques (échantillons biologiques et données associées enregistrées dans un logiciel spécialisé) conformément au référentiel en vigueur, dans les thématiques « biomarqueurs en transplantation », « maladies auto-immunes », « biomarqueurs en cancérologie » et « biomarqueurs de réponse aux anti-infectieux ».
Les activités de l’UF RCPT sont conformes aux Bonnes Pratiques Cliniques et à la réglementation en vigueur. Par ailleurs, elles sont interfacées avec les travaux de recherche de l’unité INSERM UMR1248 et les activités du CRBioLim pour la gestion d’échantillons biologiques. Par conséquent, les activités de l’UF-RCPT sont organisées dans le respect des systèmes qualité du laboratoire, qui est accrédité selon le référentiel de biologie médicale (norme ISO15189) et du CRBioLim, qui est certifié selon le référentiel des CRB (norme ISO20387).
Quelques exemples
EASY est une étude clinique sur médicaments dont le titre est « Evaluation of the Benefits of Administering Immunosuppressive Drugs as Single Daily Doses Over the First Year After Liver Transplantation » ou « Evaluation de l’intérêt d’une stratégie immunosuppressive en une administration par jour au cours des premiers 18 mois après transplantation hépatique ».
L’objectif principal est d’évaluer l’intérêt d’une stratégie immunosuppressive en une administration par jour au cours des premiers 18 mois après transplantation hépatique.
Elle utilise de plus, une stratégie de micro-prélèvements de sang capillaire à absorption volumétrique innovante développée par Trajan qui permet aux patients de réaliser de manière autonome et à domicile, les prélèvements nécessaires au suivi pharmacologique du tacrolimus.
L’étude prévoit le recrutement de 200 patients dans la quasi-totalité des centres de transplantation hépatique en France.
EASY est promue par le CHU de Limoges et bénéficie du soutien financier des laboratoires CHIESI et de la société Trajan.
La coordination est assurée par les Drs Marilyne Debette-Gratien, hépatologue et Caroline Monchaud, pharmacologue au CHU de Limoges.
ClinicalTrial numéro NCT06354179
Phase de recrutement en cours à l’automne 2025.
Pour plus d’informations :
MALAHBAR est une étude clinique dont le titre est « Albumin Modifications as Early Biomarkers of Chronic Liver Diseases (MALAHBAR) » ou « Modifications de l’ALbumine dans les Atteintes Hépatiques – un nouveau BiomARqueur ».
L’objectif principal est d’évaluer la capacité des modifications post-traductionnelles de l’albumine à prédire l’évolution de l’atteinte hépatique à 3 ans chez les patients porteurs d’une maladie du foie avancée (ACLD – Maladie chronique du foie avancée) en se basant sur les événements hépatiques « liver-related events » ou l’aggravation d’un stade de la maladie évalué par le score de Child Pugh et score du MELD.
L’étude prévoit le recrutement de 756 patients dans 7 CHU en France.
MALAHBAR est promue par le CHU de Limoges et financée par le PHRC interrégional 2022.
La coordination est assurée par les Drs Paul Carrier, hépatologue et Souleiman El Balkhi, pharmacologue.
ClinicalTrial numéro NCT06318949
Phase de recrutement en cours à l’automne 2025.
Pour plus d’informations :
| Tryptique de l’étude | Newletter N°1 mars 2025 | Newletter N°2 juillet 2025 |
REXETRIS est une étude sur données dont le titre est Relations EXposition – Effet à long terme chez le Transplanté Rénal des médicaments ImmunoSuppresseurs.
L’objectif principal d’étudier les relations entre l’exposition prolongée de patients transplantés rénaux aux médicaments immunosuppresseurs et le devenir à long terme du patient et du greffon.
La base de données REXETRIS est issue du rapprochement de 3 sources de données : ABIS (CHU de Limoges), CRISTAL (Agence de la biomédecine) et SNDS (CNAM).
Elle comporte les données de 47 842 transplantés rénaux français greffés entre 2005 et 2021.
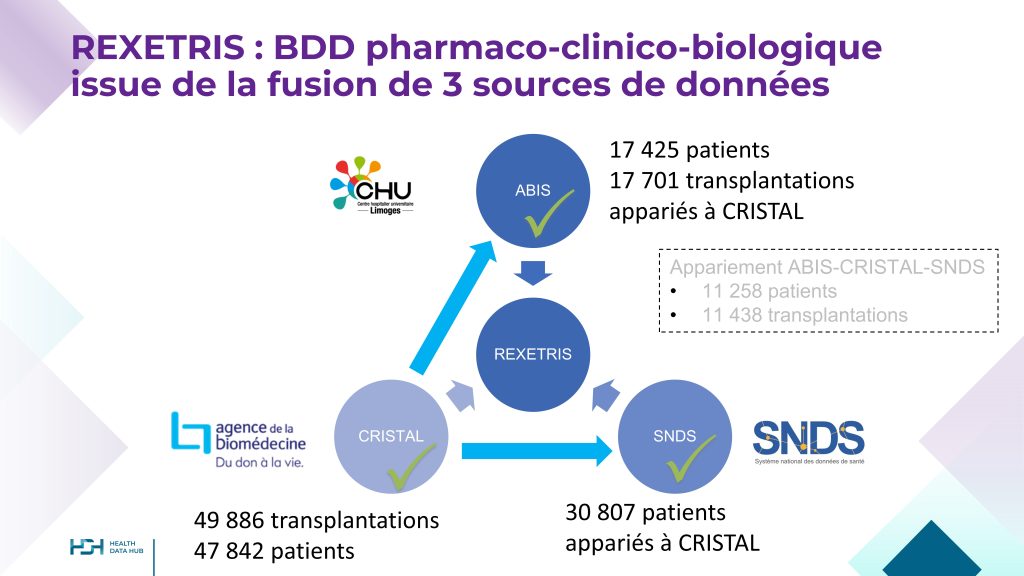
REXETRIS, lauréat du premier appel à projets du Health Data Hub en 2019, est porté par le Pr Marquet et géré par le CHU de Limoges.
Analyses statistiques en cours à l’automne 2025.
https://www.health-data-hub.fr/partenariats/rexetris
Vidéo version courte : https://www.youtube.com/watch?v=zwbTIRCBMrc
Vidéo version longue : https://www.youtube.com/watch?v=54zXVVRdndg
S. Couderc, S. Crépin, M. Labriffe et al., Dealing with large packaging in algorithms using the French health reimbursement data system (SNDS) database, Therapies, https://doi.org/10.1016/j.therap.2025.02.001
ENVARSWITCH est une étude clinique dont le titre est « PK Assessment of Tacrolimus Exposure Before and After a Switch From Twice Daily Immediate-release (Prograf®) to Once-daily Prolonged Release Tacrolimus (Envarsus®) » ou « Etude pharmacocinétique de l’exposition au tacrolimus avant et après conversion d’une formulation de tacrolimus à libération immédiate en 2 prises par jour (Prograf®) à une formulation à libération prolongée en 1 prise par jour (Envarsus®) ».
L’objectif principal était de vérifier l’absence de différence entre l’AUC0-24h de tacrolimus pré et post-conversion, calculée par estimation bayésienne, chez des patients greffés rénaux ou hépatiques convertis du Prograf® à l’Envarsus® à une dose 1:0,7, suivie d’une adaptation de posologie ciblant l’AUC0-24h pré-conversion.
L’étude utilisait une stratégie de micro-prélèvements de sang capillaire sur buvard ou DBS pour « dried blood spots », qui permet aux patients de réaliser de manière autonome et à domicile, les prélèvements nécessaires au suivi pharmacologique du tacrolimus.
Un total de 134 patients (70 transplantés rénaux et 64 transplantés hépatiques) a été inclus dans 17 centres de transplantation en France.
ENVARSWITCH était promue par le CHU de Limoges et a bénéficié d’un soutien financier des laboratoires CHIESI.
Le projet, porté par le Pr Pierre Marquet, était coordonné par le Dr Caroline Monchaud.
ClinicalTrial numéro NCT02882828
Les résultats de l’étude ont été publiés : Monchaud C, Woillard JB, Crépin S, et al. Tacrolimus Exposure Before and After a Switch From Twice-Daily Immediate-Release to Once-Daily Prolonged Release Tacrolimus: The ENVARSWITCH Study. Transpl Int. 2023 Aug 1;36:11366. doi: 10.3389/ti.2023.11366
Pour plus d’informations :
| Tryptique de l’étude |
IMPAKT est une étude clinique dont le titre est « Pharmacokinetic study of Adoport® (Tacrolimus) in patients with de novo kidney transplantation (IMPAKT) » ou « Etude pharmacocinétique de l’Adoport® (Tacrolimus) chez des patients transplantés rénaux de novo« .
L’objectif principal était de mettre au point un modèle pharmacocinétique de population pour l’Adoport® chez des patients transplantés rénaux de novo.
Un total de 30 patients transplantés rénaux a été inclus dans 4 centres de transplantation en France.
IMPAKT était promue par le CHU de Limoges et a bénéficié d’un soutien financier des laboratoires SANDOZ.
Le projet, porté par le Pr Pierre Marquet, était coordonné par le Dr Caroline Monchaud.
ClinicalTrial Numéro NCT03076151
Les résultats de l’étude ont été publiés : Marquet, P., Destère, A., Monchaud, C. et al. Clinical Pharmacokinetics and Bayesian Estimators for the Individual Dose Adjustment of a Generic Formulation of Tacrolimus in Adult Kidney Transplant Recipients. Clin Pharmacokinet 60, 611–622 (2021). https://doi.org/10.1007/s40262-020-00959-y
Pour plus d’informations :
| Tryptique de l’étude |
Ces 2 études de cohorte totalisent les données 820 patients transplantés rénaux suivis dans des centres de transplantation français pendant 10 ans pour les suivis les plus longs.
Les objectifs étaient nombreux visant notamment à décrire les stratégies immunosuppressives, les variables d’exposition aux médicaments immunosuppresseurs mais aussi d’explorer les événements indésirables, la qualité de vie ou encore l’adhésion des patients aux traitements.
Ces cohortes étaient gérées par le CHU de Limoges et ont bénéficié de soutiens financiers académique du CHU de Limoges et du PHRC interrégional 2011.
Ces projets, portés par le Pr Pierre Marquet, étaient coordonnés par le Dr Caroline Monchaud.
Les résultats et les références des publications sont présentés dans ce document.


