Modélisation Multi-échelle de la Pharmacocinétique Locale
|
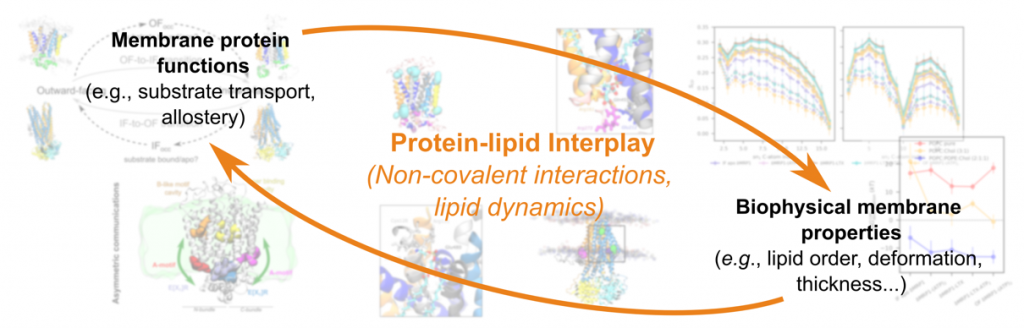
Nos recherches visent à mieux comprendre les mécanismes responsables de la variabilité des réponses aux traitements en nous concentrant sur la pharmacocinétique locale à l’aide d’approches multi-échelles. Nous étudions à la fois le rôle des transporteurs membranaires (ABC et MFS) et les mécanismes de perméation passive des molécules à travers les membranes biologiques. En combinant des techniques expérimentales et des simulations moléculaires, nous analysons les dynamiques des transporteurs et leurs interactions avec l’environnement cellulaire. |
Une part importante de nos travaux porte sur les interactions non covalentes qui gouvernent la liaison entre ligands et protéines, permettant d’affiner notre compréhension des mécanismes moléculaires à l’origine de la sélectivité et de l’efficacité des transporteurs. Nous investiguons également l’impact des mutations ou polymorphismes génétiques sur la structure et la fonction des transporteurs ABC.
Grâce à des simulations de dynamique moléculaire, nous explorons les interactions entre les médicaments et les membranes avec une résolution atomique. Nos recherches visent à prédire les coefficients de perméation passive qui gouvernent le passage des molécules à travers les membranes, et qui sont importants en pharmacologie. Plus particulièrement, notre objectif est de modéliser et comprendre la complexité des interactions entre les médicaments et les membranes.
Nous développons des modèles d’organes-sur-puce pour explorer l’influence des transporteurs membranaires sur la communication entre organes et leur implication sur la pharmacocinétique locale, en lien avec la « Remote Sensing Signalling Theory ». Ces modèles permettent de mieux comprendre les interactions complexes entre médicaments, transporteurs, et métabolites endogènes, et d’améliorer la prédiction de l’effet des traitements.