Microbiome et transplantation
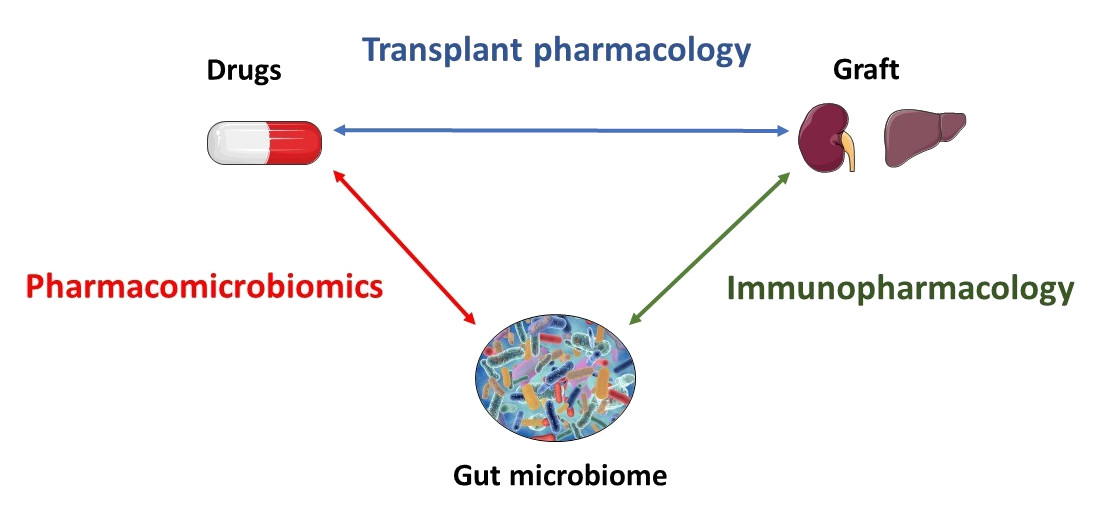
Notre unité est dédiée à la médecine de précision en transplantation en combinant des connaissances et des recherches à plusieurs échelles sur les médicaments immunosuppresseurs. Dans cette perspective, notre équipe étudie l’interaction entre le microbiote intestinal, l’hôte et les médicaments immunosuppresseurs, ainsi que sa contribution à la variabilité inter-individuelle des résultats de transplantation. C’est pourquoi nous menons plusieurs projets dans le domaine de la pharmacomicrobiomique et de l’immunopharmacologie.

Roland Lawson
Responsable
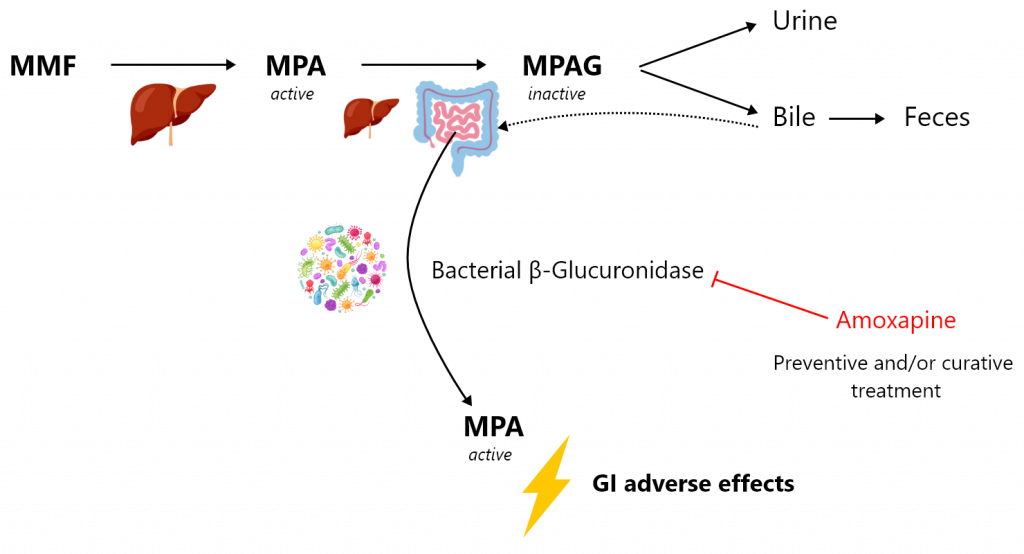
Le mycophénolate mofétil (MMF) est l’un des immunosuppresseurs les plus efficaces. Il est largement utilisé dans les transplantations d’organes solides et de moelle osseuse, ainsi que dans les troubles auto-immuns (par exemple, le lupus érythémateux, la polyarthrite rhumatoïde, l’arthrite psoriasique ou les vascularites). Malheureusement, le traitement par MMF est associé à de nombreux effets indésirables, parmi lesquels les effets gastro-intestinaux sont une préoccupation majeure. Plus de 30 % des patients se plaignent d’effets indésirables gastro-intestinaux, qui peuvent aller de simples nausées, vomissements, douleurs abdominales ou diarrhées à des ulcérations hémorragiques et des érosions du tractus gastro-intestinal. Ces effets peuvent survenir indépendamment de la durée d’exposition au MMF, entraînant une diminution significative de l’adhérence des patients au traitement. Ces effets gastro-intestinaux du MMF sont probablement médiés par la rétro-transformation intestinale du métabolite glucuronide d’acide mycophénolique (MPAG), excrété par les hépatocytes dans la bile, en sa forme active parentale, l’acide mycophénolique (MPA). Les β-glucuronidases bactériennes (β-G) exprimées par certaines espèces bactériennes du microbiome sont capables de transformer le MPAG en MPA. Ainsi, une modification du microbiote intestinal ou une dysbiose intestinale chez les patients transplantés, favorisant la prolifération de bactéries exprimant cette enzyme ou induisant son expression, est susceptible d’entraîner des concentrations accrues de MPA dans l’intestin distal, provoquant à son tour des effets indésirables gastro-intestinaux.
Notre projet vise à évaluer l’effet de l’inhibition ciblée des β-G bactériennes comme traitement préventif et/ou curatif des lésions gastro-intestinales induites par le MPA. Nous évaluerons, dans un modèle murin de colite induite par le MMF, le potentiel thérapeutique d’un inhibiteur sélectif de la β-G bactérienne, l’amoxapine. L’amoxapine est un antidépresseur utilisé chez l’homme, qui est également un puissant inhibiteur de la β-G bactérienne sans effet antibiotique. Parallèlement, nous caractériserons de nouveaux inhibiteurs candidats de la β-G bactérienne par un criblage à haut débit d’une grande bibliothèque chimique académique. Cette approche sera soutenue par une modélisation thermodynamique à l’échelle atomique de l’inhibition de la β-G.