Tetrazines et heptazines, les atouts des hétérocycles aromatiques à fort contenu d'azote Tetrazines and heptazines, the advantages of high-nitrogen content aromatic heterocycles
Les tétrazines sont des hétérocycles aromatiques stables contenant la plus forte proportion d’azote, relativement au carbone (composé générique C2H2N6). Ces composés, pourtant connus depuis un siècle, ont pourtant émergé seulement au XXIe siècle au niveau des applications les plus porteuses, la chimie click et la fluorescence ; nous présenterons quelques exemples et applications. Le cas des heptazines, un système tricyclique fusionné, même si un peu moins chargé en azote, (composé générique C6H3N7) constitue pourtant un cas assez analogue, mais encore plus marqué. En effet, la synthèse des heptazines étant plus délicate, ces molécules, pourtant très prometteuses, ont pendant longtemps été quasi-oubliées car presque non accessibles. De récents travaux ont conduit à l’obtention de deux nouveaux dérivés fonctionnalisables, ouvrant la voie à la synthèse de nouvelles familles de ces composés, et de nouvelles applications en particulier en photocatalyse, en optoélectronique ou dans le développement de matériaux hybrides.
Tetrazines are the stable aromatic heterocycles containing the highest proportion of nitrogen, relative to carbon (generic compound C2H2N6). These compounds, although known for a century, only emerged in the 21st century with the most promising applications, click chemistry and fluorescence; we will present some examples and applications. The case of heptazines, a fused tricyclic system, even if slightly less loaded with nitrogen, (generic compound C6H3N7) nevertheless constitutes a fairly similar, but even more marked case. Indeed, the synthesis of heptazines being more delicate, these molecules, although very promising, were for a long time almost forgotten because they were almost inaccessible. Recent work has led to the obtaining of two new functionalizable derivatives, opening the way to a large family of derivatives, and correlatively new applications in particular in photocatalysis, optoelectronics or in the development of hybrid materials.
Introduction
Les hétérocycles aromatiques à fort contenu d’atomes d’azotes (1-3) sont des molécules tout à fait exceptionnelles en chimie en général, et en chimie hétérocyclique en particulier. En effet, l’atome d’azote est le seul atome capable (car il est trivalent !) de remplacer de manière strictement équivalente sur le plan des liaisons, un atome de carbone dans une structure aromatique classique, c’est-à-dire de type benzénique ou analogue supérieur (naphtalénique, anthracénique, etc…) Il existe bien des atomes différents (soufre, oxygène…) capable de contribuer à la formation d’hétérocycles aromatiques, mais dans le cas de ces atomes bivalents, les 4n + 2 électrons dont le courant constituent le courant aromatique intrinsèque, doivent intégrer l’un des doublets disponible de l’hétéroatome bivalent, ce qui conduit à des systèmes notablement différents de ceux carbonés, avec un atome de moins (cas du thiophène et du furanne par exemple) ou bien de l’apparition d’une charge positive sur le cycle (cas des pyriliums et analogues). Dans la première situation on parle de système « p-excédentaires » car le nombre d’atomes est inférieur d’une unité par hétéroatome impliqué à celui des doublets d’électrons impliqués dans l’aromaticité (6 électrons contre 5 atomes par exemple dans les cas les plus simples comme le thiophène et le furanne) et dans la deuxième on a donc affaire à des composés ioniques. Dans les deux cas la réactivité chimique tout comme les propriétés se trouvent profondément modifiées.
Pour revenir aux composés qui nous intéressent, c’est-à-dire les composés classiques, dans lesquels on a juste substitué un ou plusieurs atomes de carbone par les azotes, le caractère aromatique garde à peu la même structure (type benzénique au sens large), mais on observe cependant les changements suivants :
-
Le caractère électronégatif de l’azote change les niveaux d’énergie des orbitales (même si leur structure reste la même) et le caractère nucléophile disparaît rapidement au profit d’une inertie chimique au début, suivi de l’apparition d’un caractère électrophile (1) lorsque le nombre d’atomes d’azote augmente.
-
Du fait de ce même caractère électronégatif, les électrons sont plus liés aux atomes et l’énergie liée à l’aromaticité (indiquée Fig. 1) diminue progressivement avec le nombre d’atomes d’azote. (L’alternance C/N induit aussi une dissymétrie qui perturbe un peu le courant de cycle, ce qui influe dans le même sens)
-
Lorsqu’un nombre élevé d’atomes d’azote (rapport N/C supérieur à 1, l’orbitale HOMO peut être le mélange des doublets non-liants des azotes. Dans ce cas des propriétés inhabituelles comme la fluorescence peuvent apparaître. C’est le cas avec les tétrazines (1,2) qui vont nous intéresser.
Qui plus est, le remplacement d’un atome de carbone par un atome d’azote dans un hétérocycle « classique » est plus ou moins équivalent en terme d’affinité électronique, à l’introduction d’un groupe nitro sur ce même carbone. Cela signifie par exemple que la tétrazine possède (à peu près) la même affinité électronique que le tétranitrobenzène, ce qui peut se mesurer par exemple par des potentiels de réduction, qui sont directement liés au niveau de la LUMO, comparables.
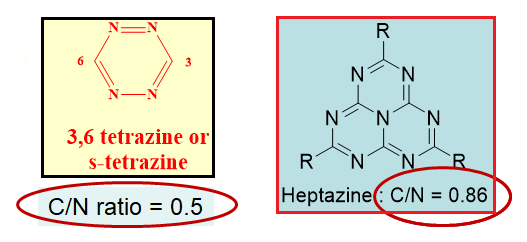
Nous allons dans ce petit article, vous présenter les s-tétrazines et les heptazines, qui répondent aux formules génériques (Fig. 1) ci-dessous, en vous rapportant quelques propriétés frappantes et applications de ces hétérocycles fascinants.
Fig. 1 : Formules respectives des tétrazines et des heptazines, avec leur rapport C/N
1. Les s-tétrazines
Les s-tétrazines sont des molécules colorées (Fig. 3) alors que des cycles de cette taille ne le sont jamais (le benzène par exemple absorbe dans l’UV lointain). Cela est dû à une transition atypique entre la LUMO de la tétrazine (qui est comme classiquement la π* du système aromatique) et la HOMO qui est (non-classiquement cette fois !) la combinaison des orbitales n des azotes adjacents. L’existence de cette orbitale anormalement haute a pour conséquence l’apparition d’une transition faiblement autorisée (elle apparaît à cause des oscillations du cycle, liées à la température, si le cycle était strictement plan elle serait interdite !) d’un coefficient d’absorption autour de 400-500 et qui est responsable de la couleur de la molécule. Indépendamment de la couleur, cette situation inédite dans un hétérocycle aussi petit, se double de l’apparition de la fluorescence, si et seulement l’orbitale de type n se trouve être la HOMO. En effet, cette orbitale est peu sensible au effets de substituants, à l’inverse de l’orbitale π, qui, elle, y est fortement sensible. Le niveau de l’orbitale π descend de ce fait en dessous de celle n si des substituants suffisamment électroattracteurs, par exemple des chlores ou des alkoxy, sont présents. A l’inverse, les substituants donneurs tels que les amines, enrichissent le système π et font de ce dernier la HOMO. Cette fluorescence hautement atypique font de ces molécules les plus petits fluorophores organiques utilisables de la chimie, et je vais vous en exposer deux applications originales et remarquables, dans leur ordre historique.
a) Révélation des empreintes digitales directement fluorescentes.
Depuis le milieu des années 70, le mode de révélation des empreintes digitales repose sur l’évaporation d’un cyanoacrylate dans des conditions parfaitement contrôlées de température et d’hygrométrie. Tous les laboratoires de police du monde utilisent ce procédé qui permet la polymérisation du composé à la surface de l’empreinte, ce qui la rend apparente, en blanc.
C’est un procédé parfait pour les substrats colorés foncés. Sur les substrats clairs, la révélation est déjà plus délicate. Enfin, lorsque l’on considère les substrats blancs ou transparents, cela ne marche carrément pas, et il faut revenir à l’usage de poudres, sprays, etc… qui non seulement sont bien moins efficaces, mais aussi abîment l’empreinte le plus souvent. Nous avons réussi à préparer une tétrazine (son nom est encore non publié hors brevet) qui s’évapore dans les mêmes conditions précisément que le cyanoacrylate, et qui a permis de préparer une « encre » (au nom commercial de Lumicyano TM) permettant de développer les empreintes digitales directement fluorescentes en une seule étape, comme le montre la figure 2 ci-dessous.
Fig. 2 : Développement d’une empreinte digitale, blanche avec un cyanoacrylate classique (à gauche) et directement fluorescente avec le Lumicyano ™ à droite.
b) Liquides fluorescents de faible viscosité.
Les liquides organiques fluorescents existent, mais ils sont en général assez, voire très visqueux, du fait de la masse molaire importante, juste de l’unité fluorophore. En effet les seules stratégies existant à l’heure actuelle étant de substituer le cœur fluorescent par des chaines « inductrices d’état liquide », la plus efficace étant la chaine 2-éthylhexyle, mais cette approche montre ses limites avec quasiment tous les fluorophores, qui présentent une masse molaire élevée, ainsi que parfois des interaction dipôle-dipôle. Cela a permis de produire un certain nombre de fluides fluorescents, mais fréquemment leur viscosité était élevée ou très élevée, au mieux comparable au miel, et au pire au goudron.
Du fait de l’extrême petitesse, et du caractère faiblement polaire du noyau tétrazine, fluorescent, nous avons pu produire des tétrazines réellement liquides, la moins visqueuse présentant à peu près la viscosité de l’huile d’olive ! Voici sur la figure ci-dessous, les formules et photos de ces deux tétrazines.
Fig.3 : Formules et images (lumière visible et UV 360 nm, 1 flacon de droite et 2, flacon de gauche) des deux tétrazines liquides (formules en bas à gauche), qui sont les liquides organiques fluorescents les moins visqueux connus.
2. Les Heptazines
a) Introduction
Toujours dans la catégorie des hétérocycles à fort contenu d’azote, nous nous sommes donc également intéressés aux heptazines (3-5), dont le cœur (Fig. 1, droite) contient 7 atomes d’azote pour 6 de carbone. Le rapport C/N est plus élevé, mais en plus il n’y a pas d’atomes d’azote adjacents, ce qui empêche tout mélange des orbitales non liantes (n) des azotes. Dans ces conditions la transition optique de plus basse énergie est de type π- π*, et la fluorescence également. Toutefois, une anomalie orbitalaire fait que ces mêmes orbitales ont un recouvrement quasi-nul, et de ce fait situe le triplet presque au même niveau, voire parfois au-dessus en énergie (dans certains cas d’heptazine disymétriques), du singulet. Cette situation, également unique chez les fluorophores purement organiques, confère à ces molécules un caractère intrinsèque de fluorescence retardée (appelée TADF, pour Thermally Induced Delayed Fluorescence)
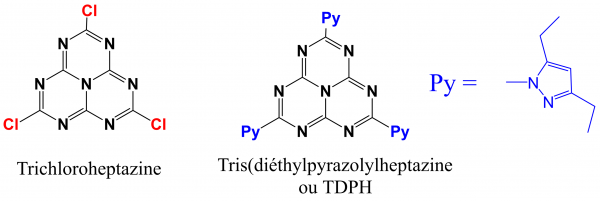
Jusqu’à l’an 2000, ces molécules étaient presque inconnues, car, mis à part de rares synthèses spécifiques, on ne connaissait pas de précurseurs d’intérêt général, et on étudiait plutôt des matériaux à base d’heptazines polymèrisées (4). Cela dura jusqu’à ce que Kroke et al.en 2000 et Audebert et al., en 2019, ne publient les premières synthèses de la trichloroheppptazine (3, 5) et de la TDPH (3) (Fig. 4 ci-dessous), qui furent les deux premières seules heptazines publiées à groupements échangeables.
Fig. 4 : Formules de la trichloroheptazine et de la TDPH.
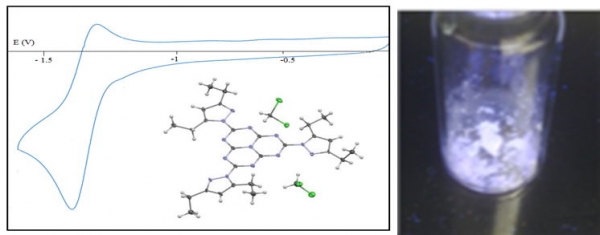
b) Caractère électrodéficitaire et fluorescence retardée.
Les heptazines présentent en général une électrochimie réversible, comme la TDPH (Fig. 5) associée à un gap optique dans le bleu ou bien le violet (3). L’association de ces deux propriétés leur confèrent des propriétés très intéressantes en photocatalyse. En effet le potentiel rédox d’oxydation des heptazines à l’état excité s’obtient en additionnant le potentiel de réduction (qui est corrélé à l’énergie de la LUMO) et le gap optique. Avec un potentiel de réduction de -1.25 V (Fig. 5) et un gap optique proche de + 2,8 V, cela fait pour la TDPH un potentiel rédox de + 1.55 V (ref Calomel), soit nettement supérieur à l’oxydation de l’eau (1.23 V vs ENH, cad + 1 vs calomel, à pH 0)
Fig 5 : Voltamétrie cyclique de réduction, structure crystalline (à gauche) et fluorescence (à droite) de la TDPH.
Des expériences de photocatalyse (génération de carbocations par oxydation sélective de thiols) ont déjà été couronnées de succès et fait l’objet d’une publication (6).
Conclusion
Ce petit synopsis des propriétés et applications des tétrazines et des heptazines vous aura, j’espère, convaincu des propriétés extraordinaires des hétérocycles à fort contenu d’azote en fluorecence et en catalyse. Ces molécules ont en effet un caratère électrodéficitaire exceptionnel, associés dans ces cas particuliers à une structure orbitalaire unique et génératrice de propriétés jamais rencontrées chez les fluorophores organiques au sens strict (seulement, et assez rarement, dans des complexes organométalliques). Je ne l’avais pas encore signalé, mais un avantage supplémentaire est la synthèse à des échelles assez importantes (quelques grammes) de tous les précurseurs. Cela en fait donc des cibles de choix, et nous continuons de travailler sur ces molécules remarquables, dans le cadre des objectifs précédemment exposés dans cet article.