Claire CARRION* & Fabienne BARAIGE**,
*PLATEFORME BISCEM, ** EpiMaCT
Dans le domaine de la biologie cellulaire, la microscopie optique en fluorescence est un outil incontournable. L’apparition d’anticorps couplés à des fluorochromes a permis la détection ciblée d’une ou plusieurs molécules au niveau tissulaire et cellulaire grâce à l’utilisation de microscopes en épifluorescence. Le développement au milieu des années 1990 de la microscopie confocale, a considérablement augmenté les capacités d’analyse au niveau cellulaire et subcellulaire. Cette technique permet de réaliser des images hautement résolues restreintes au plan de focalisation, soit quelques centaines de nanomètres. Il est devenu possible d’étudier l’organisation des cellules en trois dimensions ; les notions de localisation intracellulaire et de co-localisation de molécules ont fait leur apparition. Les analyses peuvent être réalisées sur échantillons fixés ou sur cellules vivantes.
Dans le domaine des sciences de matériaux, la microscopie confocale peut être utilisée dans le cadre d’observations d’échantillons en 3D couplés à des molécules fluorescentes, notamment des particules de silice ou d’alumine couplées avec de la fluorescéine ou de la rhodamine. La microscopie confocale peut également être utilisée pour observer des surfaces par détection de la réflexion du laser sur l’échantillon, notamment pour la mise en évidence de joints de grains.
L’IMAGERIE SPECTRALE
Un signal fluorescent est détecté par un microscope à l’aide d’un système de filtres associé à un fluorochrome donné en ne laissant passer que la lumière émise par ce fluorochrome vers le détecteur du système. L’utilisation de tels filtres entraîne une limitation du nombre de fluorochromes que l’on peut détecter en même temps, et donc du nombre de molécules observables simultanément. De nouvelles générations de détecteurs (spectraux) ouvrent de nouvelles possibilités quant au nombre de signaux de fluorescence détectables simultanément sur un même échantillon. L’imagerie spectrale permet d’identifier spécifiquement les spectres d’émission de fluorochromes en s’affranchissant de l’utilisation de filtres de fluorescence. Cette nouvelle approche permet d’augmenter le nombre de signaux fluorescents détectables simultanément et/ou d’identifier un signal endogène (autofluorescence, protéines fluorescentes type GFP et…).
LA MACROSCOPIE CONFOCALE
La macroscopie confocale permet l’observation d’échantillons épais à faible grossissement mais en conservant une bonne résolution.
Le macroscope confocal est un stéréomicroscope à faible grossissement équipé d’un système confocal pour l’acquisition d’images très bien résolue en 3 dimensions. Un tel équipement permet l’analyse de petits organismes (le poisson-zèbre par exemple), des explants tissulaires, des biomatériaux, des greffes de tumeurs, des plantules…
Sylvia M. BARDET * & Marc FABERT**,
*Xlim, **PLATINOM
BX61WI/FV1200MPE, Olympus et laser Titane-Saphir femtoseconde (Chameleon Ultra II, Coherent)
La microscopie multiphotonique : « 1 photon c’est bien, 2 photons, ce n’est pas mal non plus… ». La microscopie non linéaire a été largement diffusée à partir des années 90 grâce à Denk et collaborateurs, dont les travaux portaient sur l’imagerie à 2 photons et les réactions photochimiques induites dans des cellules biologiques. De nos jours, la microscopie non linéaire en biologie utilise principalement la technologie de laser femtoseconde (100 fs) dans l’infrarouge (700-1300 nm) pour de l’imagerie à fluorescence, de la génération de second harmonique (SHG) ou de troisième harmonique (THG).
La microscopie multiphotonique (ou encore « biphoton » dans notre cas) permet de contrecarrer certains inconvénients inhérents à la microscopie confocale, en limitant la photo-toxicité cellulaire (photo-blanchiment) et en autorisant une plus grande pénétration dans l’épaisseur du tissu (de quelques dizaines de µm à plusieurs centaines), aussi bien in vitro qu’in vivo.
Cette technologie autorise l’observation microscopique en temps réel des molécules et des activités biologiques in situ dans un environnement fonctionnel, avec une résolution spatiale et temporelle maximale, en interférant au minimum avec les structures biologiques. Elle donne par ailleurs accès à de l’imagerie 3D par reconstruction à partir des sections optiques. Un autre intérêt de cette technique est les impulsions brèves et les fortes puissances crêtes associées générées par les lasers femtosecondes, permettent d’exciter suffisamment la matière pour générer des réponses endogènes détectables et donc se passer de marquage des échantillons.
Il est important de savoir que les spectres d’émission des fluorochromes sont généralement plus étalés en excitation biphoton qu’en monophoton, à l’exemple des protéines fluorescentes dérivées de la GFP (eGFP, YFP, CFP, …). D’autre part, certains fluorochromes ne respectent pas le principe d’une excitation efficace à ʎ/2 de la longueur d’onde infrarouge utilisée, et chacun se doit d’être systématiquement testé en mode biphoton. Il est alors possible d’exciter simultanément ces fluorochromes par une seule longueur d’onde du laser pulsé et observer des compartiments tissulaires ou cellulaires bien séparés.
Au-delà de l’imagerie, la microscopie multiphotonique peut être appliquée dans le traitement de certaines pathologies, en particulier la photothérapie dynamique pour la destruction in vivo de tissus cancéreux.
Pierre CARLES & Yann LAUNAY, PLATEFORME MICROSCOPIE ELECTRONIQUE – CARMALIM
La microscopie électronique à balayage environnemental (ESEM)
La microscopie environnementale (ESEM) est une microscopie électronique à balayage ultra-polyvalente, de haute résolution qui permet d’étudier des matériaux dans leurs états naturels, dans diverses conditions, telles que des environnements humides, chauds ou réactifs sans passer par une étape de préparation.
La flexibilité des conditions de travail (trois modes de vide) permet l’observation d’une large gamme d’échantillons qu’ils soient non conducteurs électriquement et/ou non compatibles en haut vide.
Le champ d’applications est vaste et varié. Il comprend l’observation à l’échelle nanométrique de :
Métaux et alliages, fractures, soudures, profilés polis, matériaux magnétiques et supraconducteurs
Céramiques, composites, plastiques
Films/revêtements
Sections géologiques, minéraux
Matériaux mous : polymères, produits pharmaceutiques, filtres, gels, tissus, matériel végétal
Particules, matériaux poreux, fibres
Matériaux biologiques : cellules, bactéries
Il permet de réaliser des expériences dynamiques in situ et d’observer l’évolution de réactions chimiques, comme l’oxydation, la corrosion, la croissance des cristaux, la catalyse grâce à des systèmes auxiliaires. Les systèmes présents sont :
Une platine Peltier qui permet le contrôle de la température sur l’échantillon de -5 à 60°C.
Une platine chauffante qui permet le contrôle de la température sur l’échantillon de 25 à 1400°C.
Une platine traction qui permet d’appliquer des contraintes physiques sur l’échantillon.
Pour compléter la caractérisation des matériaux, ce microscope est équipé d’un système de microanalyse X (EDS). Cet outil permet d’avoir une information qualitative et quantitative des éléments présents dans le matériau, de pouvoir différencier les phases, d’effectuer des profils de concentration, de réaliser des cartographies spectrales.
La microscopie à balayage double faisceaux (SEM/FIB)
La microscopie à balayage double faisceaux (SEM/FIB) couple un microscope électronique à balayage avec une colonne ionique. Il permet d’une part l’observation morphologique et chimique à l’échelle nanométrique des échantillons et d’autre part l’abrasion de l’échantillon ou la déposition de matériaux à sa surface.
Ce microscope est équipé en périphérie de deux systèmes de caractérisation :
· Un spectromètre dispersif en énergie (EDS). Il permet l’analyse élémentaire chimique qualitative et quantitative des échantillons, l’analyse de couches, l’analyse de la répartition des éléments dans l’épaisseur, la cartographie chimique.
· La diffraction des électrons rétrodiffusés (EBSD). Il permet une étude cristallographique microstructurale des matériaux cristallins, de déterminer la texture ou l’orientation préférentielle de n’importe quel matériau cristallin.
Cet équipement peut être utilisé pour:
– L’obtention d’une section transverse dans une région d’intérêt précise d’un échantillon.
– La préparation d’une lame mince pour des observations MET.
– L’imagerie 3D en microscopie électronique, EDS et EBSD.
– La réalisation de motifs nanométriques.
– La fonctionnalisation d’objets
Maggy COLAS* & Julie CORNETTE**,
* IRCER-UMR CNRS 7315, ** PLATEFORME SPECTROSCOPIE RAMAN – CARMALIM
La spectroscopie de diffusion Raman est une technique qui utilise l’interaction inélastique de la lumière avec la matière pour sonder l’organisation de celle-ci à l’échelle des liaisons atomiques.
Au cours de cet atelier, après un rappel théorique sur la diffusion de la lumière, nous montrerons l’intérêt de cette technique non destructive et non invasive pour caractériser les matériaux possédant ou non un ordre à longue distance.
Puis nous illustrerons par des exemples, notamment concernant l’apport de l’imagerie 2D et 3D. Nous mettrons ainsi en évidence comment il est possible d’obtenir une information chimique sur la répartition spatiale des fonctions recherchées à l’échelle micronique.
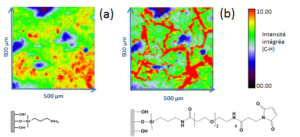
L’exemple ci dessous illustre un suivi de fonctionnalisation d’un substrat en hydroxyapatite fonctionnalisé par un silane (a) puis par le SEM(PEG)6 (b).
Cette étude a permis de mettre en évidence la localisation spatiale des molécules et la sélectivité du greffage par reconstruction des images sur l’intensité intégrée du mode de vibration C-H