Des investigations ont été réalisées pendant trois années dans cinq habitats à Limnées tronquées situés dans le département de la Haute-Vienne afin de connaître les périodes de pontes et suivre la croissance des individus en fonction de leur génération annuelle. Dans les trois fossés où circule de l’eau tout au long de l’année, une seule généra-tion annuelle de G. truncatula a été notée avec dépôt des pontes de la fin juin jusqu’au début d’octobre. Dans les deux autres habitats soumis au dessèchement estival (août et septembre), deux générations ont été observées et les pontes ont eu lieu de la mi-avril à la fin juin et de novembre à décembre. Même s’il existe des variations d’effectif et de croissance dans le cas des habitats permanents, les risques parasitaires liés aux populations présentant une seule génération annuelle sont très limités en raison du faible nombre de ces colonies dans le nord de la Haute-Vienne (3 seulement sur un total de 1.731 détectés dans les prairies de ce secteur).
Field investigations were carried out over a 3-year period in five habitats of Galba truncatula located in the department of Haute-Vienne to determine periods of egg-laying and to follow the growth of these snails in relation to their annual generation. In the three ditches with running water throughout the year, a single annual generation of G. truncatula was found and egg-masses were laid from the end of June up to the beginning of October. In the other two habitats subjected to summer drying (the sites were dried in August and September), two generations were noted and egg-deposits occurred from mid-April to the end of June and in November-December. Even if variations in the numbers of snails and their growth were found in these three permanent habitats, the parasitic risks caused by these populations showing a single annual generation were limited owing to the low number of these communities in northern Haute-Vienne (three only out of a total of 1,731 detected in these meadows of this zone).
Introduction
Galba truncatula O.F. Müller, 1774 est un petit mollusque amphibie (hauteur : jusqu’à 12 mm) que l’on rencontre fréquemment dans les prairies marécageuses, les fossés qui les bordent et sur les berges des cours d’eau. Sur les terrains granitiques de la Haute-Vienne, les populations de cette espèce sont nombreuses, avec un faible nombre d’individus par colonie (moins de 150 individus en juin) et une taille réduite (moins de 8 mm) à l’état adulte (Rondelaud et al., 2009). Plusieurs travaux antérieurs ont déjà précisé les caractéristiques des habitats dans lesquels on trouve cette limnée (Vareille-Morel et al., 1999, 2007), les autres espèces de mollusques qui y vivent (Rondelaud, 1999) et la localisation géographique de ces populations dans le nord de la Haute-Vienne par l’intermédiaire d’une cartographie (Rondelaud et al., 2000).
Si les professionnels de la santé et les chercheurs se sont intéressés à ce mollusque depuis la fin du 19e siècle, c’est en raison du rôle qu’il joue comme hôte intermédiaire dans le cycle évolutif de plusieurs Digènes. A ce titre, il assure le développement des formes larvaires de plusieurs parasites dont les plus connus sont Fasciola hepatica Linné, 1758 (Grande douve du foie) et Paramphistomum daubneyi Dinnik, 1962 (Douve de la panse des ruminants). De chaque œuf pondu par le parasite adulte, éclôt une larve (miracidium) qui pénètre dans le mollusque, s’y multiple et donne finalement des cercaires qui sortiront de la limnée. Elles évolueront ensuite pour former de futurs adultes si elles sont ingérées par un ruminant (les deux espèces précitées) ou encore l’homme (F. hepatica).
Connaître la dynamique des populations chez ce mollusque, c’est-à-dire le nombre de générations annuelles, est donc d’une importance capitale dans l’épidémiologie des maladies provoquées par ces Digènes car, à chaque génération de la limnée, peut correspondre un cycle parasitaire avec émission de cercaires (Taylor, 1965). On peut ainsi déterminer les périodes à risque au cours de l’année pour chacun de ces parasites vis-à-vis des ruminants ou de l’homme en connaissant les mois au cours desquels les émissions cercariennes ont lieu. De nombreux travaux (revue de Taylor, 1965 ou celle de Torgerson et Claxton, 1999) ont déjà précisé les caractéristiques de cette dynamique lorsque la population de la limnée présente deux ou trois générations annuelles. Le modèle à deux générations est le plus fréquent dans le département de la Haute-Vienne, avec l’une printanière et l’autre transhivernante. L’autre modèle à trois générations, avec une supplémentaire en été, ne se rencontre que lors des années avec une pluviométrie élevée (Rondelaud et al., 2009). C’est d’ailleurs un modèle de ce type qui est à l’origine de l’épidémie de fasciolose survenue en 1969 dans le Montmorillonnais et la Basse-Marche, avec plus de 250.000 ovins morts en 15 jours (Duret, 1969).
Si les populations à deux ou trois générations annuelles sont relativement bien connues dans les pays tempérés, il n’en est pas de même pour les colonies de G. truncatula qui ne présentent qu’une seule génération par an. Des études sur ce dernier cas ont déjà été réalisées sur des colonies de limnées vivant sur des berges de rivière (Dreyfuss et al., 1997) comme sur des populations d’altitude vivant dans l’est de la Creuse (Rondelaud et Mage, 1992) ou dans les Alpes et le Jura (de Massias et al., 1996). Mais ces premiers travaux ne permettent pas une généralisation en raison des problèmes suivants. Sur les berges de rivière dans la Haute-Vienne, la plupart des habitats à G. truncatula sont submergés de la mi-novembre jusqu’au début d’avril si bien que les comptages de mollusques ne peuvent pas être réalisés durant cette période (Dreyfuss et al., 1997). De plus, certaines colonies comme celles de Saint-Priest-Taurion présentent, selon les années, une ou deux générations annuelles (Hourdin et al., 2006). Dans les populations d’altitude, la présence de neige et de glace en hiver ne permet pas de suivre les variations numériques des limnées dans ces populations.
Afin d’étudier correctement des communautés à une seule génération annuelle, il était donc utile de s’intéresser à des colonies vivant en plaine, en dessous de 400 m d’altitude. Une étude rétrospective a été réalisée par l’un d’entre nous sur les 1.731 gîtes à G. truncatula identifiés dans des fermes situées dans le nord de la Haute-Vienne de 1980 à 2002. Sur ce total, seules trois sites présentaient une seule génération annuelle. Une étude de trois années a donc été entreprise dans ces lieux afin de répondre aux questions suivantes : quelle est la période de pontes dans ces trois populations ? Comment la dynamique de ces limnées évolue-t-elle au cours de l’année ?
Comme il existe des différences dans les variations numériques de la limnée en fonction des conditions climatiques locales (Smith et Wilson, 1980), nous avons complété cette étude en effectuant également des observations dans deux populations présentant chacune deux générations annuelles et vivant juste à proximité (moins de 100 m) des colonies à une seule génération.
Matériel et méthodes
1. Stations d’étude
Les cinq populations de G. truncatula vivent dans le nord et l’ouest du département de la Haute-Vienne. Les trois premières ne présentent qu’une seule génération annuelle. Elles colonisent i) un fossé (45° 57’ 25” N, 1° 10’ 20” E) situé le long de la route D 128, au lieu-dit La Petite Châtre, commune de Saint-Jouvent (site A), ii) un autre fossé (45° 52’ 45” N, 1° 5’ 55” E) le long de la route D 9 au niveau du poste du gaz, commune de Veyrac (habitat B), et iii) un fossé de drainage (46° 11’ 8” N, 0° 59’ 25” E) localisé dans une prairie marécageuse à proximité de la Grande Gagne, commune de Saint-Sornin-la-Marche (site C). Ces trois habitats sont parcourus tout au long de l’année par de l’eau courante en provenance de sources permanentes situées à proximité. Dans chaque cas, les mollusques vivent dans une déclivité en aval d’une buse et sont à l’ombre de grands arbres durant la plus grande partie de la journée, tout au moins en été. A l’exception des buses qui sont nues dans leur partie aval, les berges de chaque déclivité et une partie du fond sont recouvertes par une végétation semi-aquatique (Juncus effusus Linnaeus, 1753, et Glyceria fluitans R. Brown, 1810).
Les deux habitats, où vivent les populations à deux générations annuelles, se situent à proximité des habitats B et C. Dans le premier cas, il s’agit d’une zone marécageuse (habitat D), localisée à proximité même du poste du gaz. Dans le second, le site est l’extrémité distale d’une rigole de drainage superficiel (E) proche du fossé correspondant. Dans ces deux zones, l’eau est temporaire avec disparition de celle-ci au cours des mois d’été (généralement à partir de début juillet). La végétation est essentiellement représentée par Juncus acutiflorus Ehrhart ex-Hoffmann, 1791 dans les deux zones, avec en plus Echinochloa crus-galli Linnaeus, 1758 dans l’habitat D. Sur la commune de Saint-Jouvent, une population à deux générations annuelles a été également prise en compte en janvier 2004 mais le curage du fossé à la fin de la même année n’a pas permis de continuer les comptages sur ce site.
Les zones occupées par les habitats A, B et C ont une superficie respective de 13,7, 10,8 et 8,6 m2 tandis que les nombres correspondants de limnées transhivernantes sont de 107, 81 et 63 en janvier 2004. A l’inverse, la superficie est plus réduite dans les sites D (4,5 m2) et E (3,1 m2) pour une abondance respective de 68 et de 84 G. truncatula en janvier 2004.
2. Protocole d’étude
Des investigations bimensuelles ont été réalisées dans ces cinq habitats de janvier 2004 à décembre 2006. Chaque prospection porte sur dix quadrats de 1 m2 chacun (deux par habitat). Chacun d’entre eux recouvre le fond (du fossé, de la rigole ou de la zone marécageuse) et les pentes correspondantes sur une hauteur de 8 à 15 cm environ. En effet, G. truncatula est connu pour être une espèce amphibie avec sortie de l’eau lorsque les conditions sont favorables (Rondelaud, 1974).
La hauteur de la nappe d’eau, la vitesse de l’eau courante sur une distance de 50 m et la température de celle-ci à 5 cm de profondeur (à 14 heures) ont d’abord été déterminées dans la partie centrale de chaque fossé, de la rigole ou de la zone marécageuse. Des comptages ont ensuite eu lieu pour connaître le nombre total de mollusques et celui des pontes sur chaque quadrat. Enfin, un nombre variable de limnées choisies au hasard (de 30 à 50 selon la superficie de l’habitat et l’abondance de la population) a été récolté pour mesurer leur hauteur de coquille sous une loupe binoculaire (les mollusques sont replacés dans leur habitat après les mesures) et déterminer le pourcentage de jeunes limnées (2 mm de hauteur ou moins) pour chaque date de prospection. Aucun comptage n’a été réalisé dans les habitats à deux générations annuelles lors de l’estivation (août, septembre).
Les valeurs individuelles obtenues pour chaque paramètre au cours de ces trois années ont été regroupées afin de les exprimer pour une seule année. Des moyennes et leurs écarts types ont été calculés en tenant compte de la date de prospection. Un test de Kruskal-Wallis (Stat-Itcf, 1988) a été utilisé pour établir les niveaux de signification statistique dans le cas des paramètres biologiques.
Résultats
1. Paramètres environnementaux
1.1. Populations à une seule génération annuelle
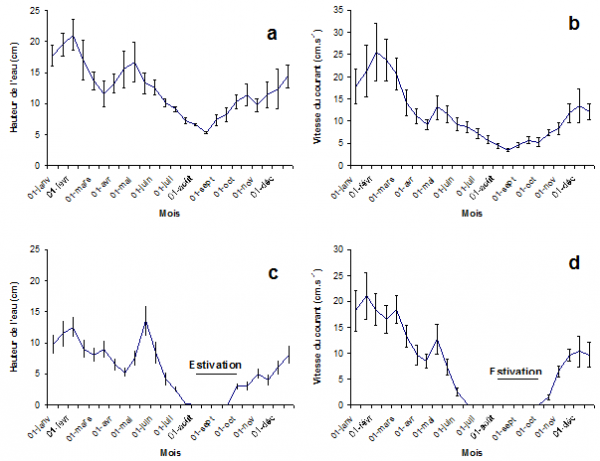
Dans les trois fossés, la hauteur moyenne de la nappe d’eau (Fig. 1a) présente un pic au début de février (à 21,1 cm) et diminue progressivement par la suite jusqu’à la fin mars avant de présenter une légère augmentation en mai. Par la suite, une autre diminution s’observe jusqu’à la fin août (à 4,1 cm), suivie d’un accroissement progressif de la hauteur jusqu’en décembre.
La même évolution peut être notée pour la vitesse de l’eau courante (Fig. 1b) dans la zone centrale des fossés. Après un premier pic au début de février et un autre en mai, la vitesse diminue progressivement jusqu’à la fin du mois d’août (à 3,5 cm/sec) avant de s’accroître ensuite jusqu’en décembre.
La température de l’eau (résultats non représentés) s’accroît jusqu’en août mais la plupart des valeurs au cours de ce mois se situent entre 13° et 16° à 14 heures.
Figure 1. La hauteur de la nappe d’eau (1a, c) et la vitesse du courant (1b, d) dans les trois habitats à une seule génération annuelle pour G. truncatula (1a, b) et dans les deux sites où l’on trouve deux générations pour cette limnée (1c, d).
1.2. Populations à deux générations annuelles
Dans la rigole et la zone marécageuse étudiées, la hauteur de la couche d’eau (Fig. 1b) présente la même évolution au début de l’année que dans les trois fossés mais celle-ci est moins marquée si l’on excepte le pic à la mi-mai (à 13,5 cm). Les deux sites sont à sec en août et septembre (estivation) si bien que l’eau ne réapparaît qu’au début d’octobre pour s’accroître progressivement en hauteur jusqu’en décembre.
L’estivation retentit également sur la vitesse de l’eau courante (Fig. 1d). Malgré de légères fluctuations, la vitesse moyenne diminue progressivement depuis janvier jusqu’au début de juin. L’eau est ensuite stagnante en juin et juillet avant de disparaître en août et septembre. A partir de la fin octobre, on note la réapparition de l’eau courante et une augmentation régulière de sa vitesse.
Jusqu’en mai, la température de l’eau (valeurs non fournies) est identique à celle relevée dans les habitats où vivent les populations à une seule génération annuelle. En juin et juillet, on note une augmentation de la température lorsque l’eau est stagnante (jusqu’à 22° C à 14 heures). D’octobre à décembre, les valeurs sont de même similaires à celles des fossés à courant permanent.
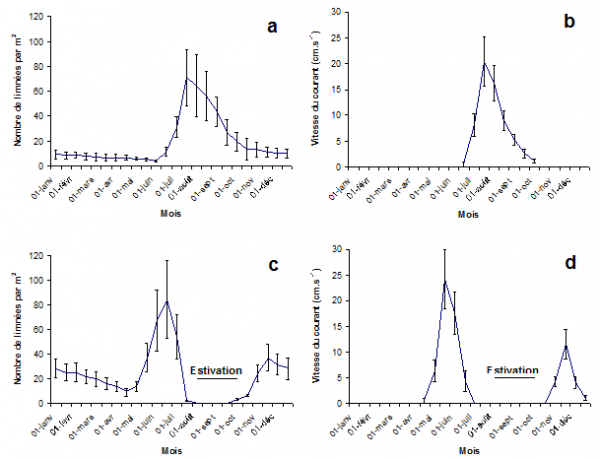
Figure 2. Le nombre total de limnées par mètre carré d’habitat (2a, c) et celui des pontes correspondantes sur la même surface (2b, d) dans les trois habitats à une seule génération annuelle pour G. truncatula (2a, b) et dans les deux sites où l’on trouve deux générations pour cette limnée (2c, d).
2. Les effectifs des limnées
La figure 2 indique l’effectif total des limnées et celui des pontes par mètre carré d’habitat pour les deux types de populations.
Dans les habitats à une seule génération annuelle, le nombre des limnées (Fig. 2a) diminue progressivement de janvier jusqu’au début de juin (à 3,9 adultes). Un accroissement significatif de la population (H = 77,63 ; P < 0,1 %) se produit à partir de ce dernier mois avec un pic à la fin juillet (à 71,3 limnées/m2), suivie d’une légère diminution jusqu’à la fin septembre et d’une autre plus importante jusqu’en décembre. Par rapport aux variations saisonnières que l’on constate dans l’effectif des limnées, les pontes de G. truncatula (Fig. 2b) ont seulement été observées de la fin juin jusqu’au début d’octobre. Les valeurs les plus élevées ont été notées à la fin juillet (à 20,4/m2) et au début d’août (à 16,2/m2) alors que les autres valeurs sont significativement plus faibles (H = 36,71 ; P < 0,1 %). Ces résultats montrent que la période de ponte dure 3,5 à 4 mois dans les habitats à une seule génération annuelle.
Lorsqu’il y a deux générations annuelles, le nombre total de limnées par mètre carré d’habitat (Fig. 2c) présente deux pics, l’un à la mi-juin (à 84,3/m2) et l’autre à la mi-novembre (à 37,2/m2). Le pic noté en juin est significativement plus important (H = 64,31 ; P < 0,1 %) que celui de novembre. Une remarque similaire peut être formulée pour les deux périodes de ponte (mi-avril-fin juin, et novembre-décembre), avec un nombre de pontes (Fig. 2d) significativement plus élevé au cours de la première période (H = 56,12 ; P < 0,1 %).
3. La croissance des limnées
Les résultats sont fournis sur la figure 3.
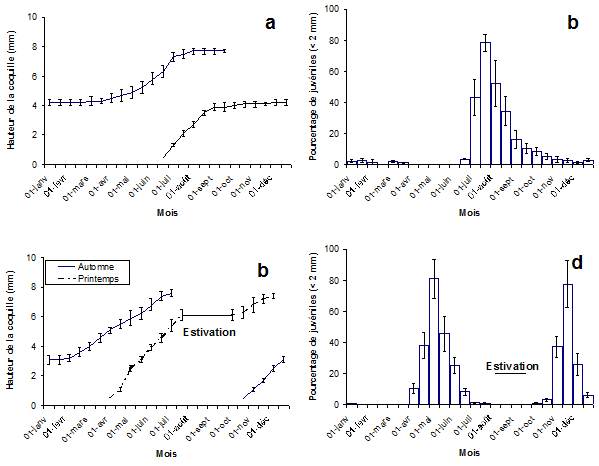
Figure 3. La croissance des limnées (3a, c) et l’évolution numérique des juvéniles (3b, d) dans les trois habitats à une seule génération annuelle pour G. truncatula (3a, b) et dans les deux sites où l’on trouve deux générations pour cette limnée (3c, d).
Dans les populations à une seule génération annuelle, la hauteur de la coquille (Fig. 3a) s’accroît jusqu’à 4,1 mm de juillet jusqu’à octobre. Par la suite, la croissance est fortement ralentie jusqu’à la fin mars de l’année suivante et reprend en juin et juillet avant de présenter un autre plateau à 7,7 mm en août et septembre. Ce paramètre présente une variation significative (H = 87,97 ; P < 0,1 %) au cours de l’année. Parmi les différentes classes d’âge, les juvéniles mesurant ≤ 2 mm en hauteur ont également montré une variation significative (H = 53,95 ; P < 0,1 %) avec des pourcentages supérieurs à 30 % en juillet et août alors que les autres valeurs diminuent progressivement jusqu’à la fin mars de l’année suivante.
Dans les deux autres populations (Fig. 3c), la croissance de la coquille au cours de l’année varie selon la génération. Chez les limnées transhivernantes, on note la même évolution que celle observée dans le cas d’une seule génération annuelle mais la reprise de la croissance l’année suivante est plus précoce (à partir de février) et la quasi-totalité des adultes disparaît au début de l’estivation. Chez les limnées nées au printemps, la croissance est rapide pour atteindre 6 mm en moyenne au début de l’estivation. En octobre, la croissance se pour-suit et les dernières limnées de cette génération disparaissent en décembre. Ces variations de croissance au cours de l’année sont significatives (H = 68,43 ; P < 0,1 %). Si l’on considère les juvéniles de hauteur égale ou inférieure à 2 mm (Fig. 3d), on constate également deux pics au cours de l’année, le premier vers la mi-mai et l’autre à la mi-novembre. Ces variations numériques sont également significatives (H = 37,34 ; P < 0,1 %). Mais à l’inverse des colonies à une seule génération annuelle, les juvéniles disparaissent au début de janvier (au lieu de la fin mars).
Discussion
Les résultats obtenus dans les habitats où vivent les populations de G. truncatula à deux générations annuelles concordent avec les observations que Morel-Vareille (1973) a réalisées dans le même secteur (nord de la Haute-Vienne) et avec celles que d’autres auteurs comme Mehl (1932), Roberts (1950), Kendall (1953), Chowaniec et Drozdz (1958), Bednarz (1960), Heppleston (1972) ou Smith (1981) ont effectuées dans d’autres pays européens sous climat tempéré. Par contre, les informations sur les colonies de limnées à une seule génération annuelle sont encore peu nombreuses et les commentaires de nos résultats seront centrés sur ces dernières populations.
Dans les trois fossés étudiés, la période des pontes s’étale de la mi-juin jusqu’au début du mois d’octobre. Elle est nettement plus longue que les deux mois (août-septembre) rapportés par Rondelaud et Mage (1992) ou par Massias et al. (1996) dans des habitats dont l’altitude se situe entre 600 et 1.950 m. Cette différence peut s’expliquer en reliant cette période de 3,5 à 4 mois aux conditions climatiques et hydrologiques locales qui sont plus favorables en plaine pour la vie du mollusque qu’en altitude. En effet, la plupart des pontes (Fig. 2b) sont déposées de la mi-juillet à la mi-août (au lieu du mois d’août dans les habitats d’altitude) et leur densité peut atteindre une moyenne de 20,4/m2 à la fin juillet (au lieu de 8,4/m2 en août à 600 m d’altitude : Rondelaud et Mage, 1992).
A partir d’août, le nombre de limnées présente une diminution progressive jusqu’au mois de juin de l’année suivante. En effet, il décroît de 71,3/m2 à la fin juillet jusqu’à 10,2/m2 à la fin décembre et cette baisse continue l’année suivante jusqu’à 3,9 mollusques/m2 à la fin juin (Fig. 2a). Si l’on fait exception du dessèchement estival qui provoque la mort de nombreux mollusques dans les habitats temporaires (Taylor, 1965), cette diminution numérique importante notée dans ces fossés en eau permanente n’avait jamais été observée dans le cas des habitats temporaires situés en plaine lorsqu’ils sont en eau. D’après Rondelaud (1977), le nombre de limnées vivant dans ces sites temporaires au début de décembre est proche de l’effectif que l’on note au mois d’avril suivant pour la même génération de limnées. Cette baisse peut s’expliquer en admettant une prédation plus importante de ces mollusques par diverses espèces dans ces fossés en eau permanente.
Plus surprenante est la présence de quelques juvéniles (≤ 2 mm de hauteur) dans ces habitats depuis décembre jusqu’au mois de mars suivant alors que les autres individus semblent avoir une croissance normale. Comme aucun mollusque mesurant 2-2,5 mm de hauteur n’a été trouvé en avril, en mai ou en juin, ce résultat est plus difficile à interpréter. A notre avis, l’hypothèse la plus probable est de considérer ces jeunes limnées comme les descendants nés à partir des œufs pondus à la fin septembre et au début d’octobre. L’accroissement du niveau de l’eau comme de sa vitesse ainsi que la chute de la température au cours des mois d’hiver aurait un effet sur ces mollusques en créant des conditions défavorables pour leur croissance, probablement par un manque de nourriture si bien que ce contingent de jeunes limnées finit par disparaître.
Dans ces habitats en eau permanente, la hauteur moyenne des limnées adultes est de 7,7 mm en août et septembre. Sur sols acides, une hauteur moyenne de 9 mm a déjà été rapportée pour des adultes vivant dans des rigoles de drainage superficiel creusées dans des prairies marécageuses (Vareille-Morel et Rondelaud, 1972 ; Vareille-Morel et al., 1999) ; dans les populations qui habitent sur les berges de rivière, la hauteur des adultes reste faible et ne dépasse pas 6-6,5 mm (Hourdin et al., 2006). Comme la taille maximale des adultes vivant sur sols calcaires est 12 mm (Germain, 1930/1931), la faible concentration de l’eau en ions calcium dissous (souvent moins de 20 mg/L d’après Guy et al., 1996) a été d’abord considérée comme le facteur limitant la croissance de ces gastéropodes sur sol acide (Vareille-Morel et Rondelaud, 1972). Comme la qualité et la quantité de l’alimentation fournie aux limnées a un effet sur la croissance de G. truncatula (Kendall, 1953), l’hypothèse la plus valide pour expliquer ces hauteurs plus faibles des mollusques serait de considérer ces fossés en eau permanente comme des habitats dans lesquels la nourriture est de piètre qualité ou est insuffisante en quantité. Cette interprétation s’appuie sur la revue de Taylor (1965). D’après cet auteur, tous les individus présents dans des habitats en eau permanente ("habitats réservoirs") restent petits de manière invariable.
Est-ce que ces habitats qui restent en eau tout au long de l’année, posent un problème sur le plan de la santé animale ? En effet, la limnée est connue depuis longtemps pour être le mollusque hôte de parasites comme F. hepatica qui affectent surtout les ruminants locaux (Mage et al., 2002). A notre avis, leur faible nombre (trois seulement sur 1.731 sites à G. truncatula dénombrés au cours des 38 dernières années dans les prairies du nord de la Haute-Vienne) limite fortement les risques parasitaires que ces mollusques peuvent créer. Un argument supportant cette interprétation est la présence, dans la quasi-totalité des pâtures de ce secteur, d’abreuvoirs artificiels dans lesquels les ruminants ont l’habitude de boire (Ron-delaud et al., 2006, 2009) si bien que ces habitats, même s’ils restent en eau en été, sont délaissés par les ruminants, ce qui évite ou tout au moins limite leur contamination par les parasites que ces limnées transmettent.