Micropropagation d’Atropa belladonna et de Mandragora officinarum : évaluation du développement sur différents milieux de culture et analyse de quelques marqueurs biologiques Micropropagation of Atropa belladonna and Mandragora officinarum: evaluation of development on different media and analyse of biological markers
Alexandre GALLOIS ,
Sylvain DULAURENT ,
Julien MORICHON ,
Franck SAINT-MARCOUX
et Pascal LABROUSSE
La belladone et la mandragore ont été cultivées in vitro, sur le milieu de MS dans un premier temps avec douze équilibres de régulateurs hormonaux (6-benzyl aminopurine et acide 1-naphtalène acétique). Quelques marqueurs biologiques ont été dosés ; il s'agit des chlorophylles a, b et des caroténoïdes, des protéines totales, du potentiel osmotique et des alcaloïdes tropaniques (atropine et scopolamine). La deuxième phase de culture a consisté à cultiver la belladone sur les milieux 0/0 et 7,5/5 (BAP/ANA) et la mandragore sur le milieu de Murashige et Skoog (0,11 µM/0,89 µM). Lors de cette deuxième phase, les protéines, le potentiel osmotique et les alcaloïdes tropaniques ont été dosés dans la belladone. Dans la mandragore, seules l'atropine et la scopolamine ont été recherchées puisque, quel que soit l'équilibre en phytohormones, les cals ne se sont jamais différenciés. Les résultats obtenus, en CL-SM/SM, ont montré que chez la belladone, le milieu sans hormone était celui qui permettait d'obtenir les plus fortes concentrations en atropine et en scopolamine. Toutefois, ces valeurs restent bien inférieures à celles trouvées dans la littérature. La mandragore, quant à elle, n'a pratiquement pas produit de métabolites secondaires.
Nightshade and mandrake were cultivated in vitro. At first on twelve balance of growth regulators (6-benzyl amino purine and 1-naphtalene acetic acid). Some biological markers were measured; chlorophyll a, b and carotenoids content, total protein content, osmotic potential and tropane alkaloid (atropine and scopolamine). The second phase of culture nightshade was cultivated on media 0/0 and 7,5/5 (BAP/NAA) and mandrake on Murashige and Skoog medium. During this second phase, protein, osmotic potential and tropane alkaloid content were measured in nightshade. In mandrake, only content atropine and scopolamine were measured. Mandrake callus and whatever the balance of growth regulator never present differentiated stages. Results from LC-MS/MS analyse have shown that from nightshade, media without growth regulator induced the highest contents of atropine and scopolamine. However, these values are smaller than those described in other studies. Mandrake has not produced secondary metabolites.
I Introduction
La belladone (Atropa belladonna) et la mandragore (Mandragora officinarum) sont deux plantes de la famille des Solanacées. C'est une famille importante en thérapeutique qui est identifiée pour ses propriétés sympathomimétiques ou parasympatholytiques. Les Solanacées sont connues pour leur utilisation alimentaire, médicinale et leurs toxicités. L'extraction des principes actifs a permis d'obtenir quelques médicaments à base d'atropine, d’hyoscyamine et de scopolamine (encore appelée hyoscine) qui sont des alcaloïdes tropaniques. La production de principes actifs comme les alcaloïdes tropaniques peut être réalisée par la culture de plantes en plein champs, mais le rendement est souvent variable et soumis à des facteurs biotiques (pathogènes...) ou des facteurs abiotiques (température, sécheresse...). Les produits issus du métabolisme peuvent être alors obtenus par synthèse chimique mais le coût peut être élevé et la synthèse complexe. A l'heure de la « chimie verte », d'autres alternatives se présentent comme les procédés biotechnologiques incluant la culture in vitro. Ce mode de culture permet de s'affranchir entre autres des variations climatiques, du risque induit par les agents pathogènes, des conditions du sol. Toutefois, à l'heure actuelle, cela n'est que rarement un moyen de production a échelle industrielle pour un principe actif. La technique de la culture in vitro permet, entre autres, de connaître les besoins des végétaux, de les multiplier rapidement pour une future acclimatation des espèces en voie de disparition. Mais c'est également un moyen de culture « rapide » à l’échelle expérimentale. Ainsi, le but de ce travail était d’étudier s'il était possible de modifier la synthèse de ces alcaloïdes tropaniques dans des cultures in vitro de belladone et de mandragore. Nous souhaitions répondre à deux questions majeures : 1/quel serait le milieu de culture le mieux adapté à la production de métabolites secondaires pour la belladone et pour la mandragore ? et 2/ est-il possible d'optimiser le taux de production des alcaloïdes tropaniques. La belladone et la mandragore ont donc été cultivées in vitro dans différents équilibres de régulateur de croissance et des mesures de concentrations en chlorophylles, en protéines et en alcaloïdes tropaniques ont été réalisées afin de voir si la production de ces alcaloïdes pouvait être impactée par la balance hormonale utilisée dans le milieu de culture ou modifiée par l'ajout de précurseur (comme l'ornithine) ou de substance pouvant stimuler le métabolisme secondaire (comme l'acide acétylsalicylique). En effet, l'acide acétylsalicylique est considéré comme un régulateur du stress chez les végétaux notamment en déclenchant la synthèse de protéines de résistance vis-à-vis de divers agents pathogènes (virus, champignons) et de l'ozone. Il agit localement en inhibant les catalases, ce qui conduit à une accumulation d'H2O2 qui joue le rôle de messager secondaire. L'ornithine, quant à elle, est un précurseur de la biogenèse des alcaloïdes tropaniques.
II Matériel et méthode
Dans une première phase de culture, la mandragore et la belladone ont été cultivées dans des milieux présentant douze équilibres de régulateurs de croissance différents (auxine/cytokinine). L’auxine utilisée était l’acide 1-naphtalène acétique (ANA) et la cytokinine utilisée était la benzyl adénine ou 6-benzyl amino purine (BAP). Une seconde phase de culture a été réalisée en sélectionnant les deux meilleurs milieux pour la belladone et un seul pour la mandragore afin d'essayer d’accroître la biosynthèse des alcaloïdes tropaniques en complémentant ces milieux d’une part avec un précurseur de cette biosynthèse, l'ornithine, et d'autre part, avec de l'acide acétylsalicylique (AAS) qui peut stimuler le métabolisme secondaire.
2.1 Matériel végétal
Les cultures de cal d’Atropa belladonna et de Mandragora officinarum utilisées, après avoir été établies à partir de semis in vitro, étaient entretenues au laboratoire dans des boites de culture (Vitrovent High Model, 80*110*100 mm) contenant150 mL de milieu de Murashige et Skoog (1962) supplémenté avec différentes doses de BAP et d’ANA stérilisé par autoclave (Systec DB90). Elles sont cultivées dans une chambre de culture à 24 ± 2°C, avec une photopériode de 16h/24h et une intensité lumineuse de 298 ± 66 lux.
2.2 Phase 1 : sélection des équilibres en régulateur de croissance permettant d’obtenir le meilleur rendement
Afin de sélectionner le milieu ayant le meilleur rendement, douze milieux avec des équilibres hormonaux différents ont été préparés. Chaque équilibre a été testé sur la belladone et la mandragore pendant 35 jours. Les douze concentrations hormonales en BAP et ANA (μM) sont : 0/0 – 0/5 – 0/7,5 – 5/0 – 5/5 – 5/7,5 – 7,5/0 – 7,5/5 – 7,5/7,5 – 10/0 – 10/5 – 10/7,5. (Delmail et al., 2012 ; Zarate et al., 1997)
Pour chaque espèce et pour chaque équilibre, trois boites de culture ont été préparées.
2.3. Phase 2 : évaluation de la supplémentation en précurseur (ornithine) ou en éliciteur (acide acétylsalicylique) sur la production de métabolites secondaires
Pour la belladone, les milieux sélectionnés sont ceux supplémentés avec 0/0 et 7,5/5 BAP/ANA (en μM). Ils sont supplémentés soit avec un éliciteur, l'acide acétylsalicylique (AAS) a une concentration de 2.10-3 mmol/L, soit avec un précurseur, l’ornithine à 2.10-3 mmol/L et 2.10-2 mmol/L. Un milieu témoin sans ornithine ni AAS est également préparé. Chaque expérience est réalisée sur trois boites de cultures. (Kazemi, 2013 ; Lee et al 2001 ; Nussbaumer et al., 1998 ; Ballicar et al., 1993)
Pour la mandragore, le milieu sélectionné est celui supplémenté en ANA et BAP à 1 mg/L soit 0,11μM et 0,89 μM respectivement. Trois boites de cultures ont été utilisées comme témoin, trois autres étaient supplémentées en AAS à 2.10-3 mmol/L et trois supplémentées en ornithine à 2.10-3 mmol/L.
2.4 Dosage des pigments photosynthétiques
Les concentrations en chlorophylles a, b et en caroténoïdes totaux (xanthophylles et β-carotène) sont mesurées à partir d'une méthodologie adaptée par D. Delmail du protocole de Arnon (1949). (Pompelli et al., 2013 ; Bettaieb et al., 2008 ; Porra et al., 2002 ; Lichtenhaler et Wellburn 1983 ; Arnon, 1949) Chaque échantillon est analysé en duplicat.
2.5 Extraction et dosage des protéines
La méthode d'extraction employée ici est une méthodologie développée par D. Delmail à partir du protocole de Srivastava et al. (2006).(Hill et al. ; 2010)La méthode de Bradford (1976) est utilisée pour déterminer la concentration en protéines totales présente dans chaque échantillon. Ce procédé est un dosage colorimétrique en spectrophotométrie UV-visible basé sur le changement d'absorbance à 595 nm du bleu de Coomassie. Par manque de matériel, une seule mesure d'absorbance a pu être effectuée pour échantillon.
2.5 Mesure du potentiel osmotique
Le potentiel osmotique (ψs) est déterminé à l'aide d'un osmomètre à tension de vapeur (13 DR Automatic, Roebling). La valeur est donnée en mosm/kg d'H2O.
Seul le potentiel osmotique de la belladone a pu être mesuré sur les douze équilibres hormonaux de la phase 1. Lors de la deuxième phase de la manipulation, le potentiel osmotique de la belladone cultivée sur les équilibres hormonaux 0/0 et 7,5/5, ainsi que sur les milieux supplémentés avec l’AAS ou l'ornithine ont été mesurés.
Pour chaque analyse 500 mg de matériel végétal sont broyés dans 1 ml d'eau distillée, puis centrifugés à 15 000 rpm pendant 15 minutes à 4°C (3-18K, Sigma-Aldrich). Les données obtenues (en mosm/kg d'H2O) sont converties en MPa (-2,5 MPa correspondent à 1 000 mosmol/kg). Une seule mesure a pu être effectuée pour chaque milieu.
2.6 Dosage des alcaloïdes tropaniques
Les alcaloïdes tropaniques ont été dosés en chromatographie liquide couplée à de la spectrométrie de masse en tandem (CL-SM/SM). Cette méthode avait été développée pour quantifier l'hyoscyamine (atropine) et la scopolamine chez 4 taxons de Datura. (D. innoxia, D. metel, D. stramonium et D. stramonium var tatula). (Jakabova et al., 2012)
2.7 Essai de perte à la dessiccation
Pour déterminer la teneur en alcaloïdes tropaniques des échantillons et la comparer à celles définies par la Pharmacopée Européenne, quelques grammes de plante fraîche cultivée in vitro ont été placées à l'étuve (T = 100-105°C) jusqu'à ce que leur masse ne diminue plus (4 jours).
III Résultats et discussion
3.1. Observations macroscopique
Pour la belladone (figure 1), dans le milieu sans régulateur de croissance (0/0), les cals ne se développent pas alors que la pousse des tiges est conséquente avec une longueur des entre-nœuds importante (1 à 2 cm). De plus, les racines sont bien développées.
Figure 1 : Atropa belladonna au terme de la culture (35 jours) dans chacun des équilibres hormonaux.
Dans les milieux ne contenant pas de BAP et quelle que soit la concentration en ANA, (milieu 0/0 et 0/7,5), les cals ne se développent pas mais il y a formation de tiges et de feuilles. Cependant, dans le milieu 0/7,5, il y a apparition d'une chlorose. Dans ces deux équilibres hormonaux (sans cytokinines) des racines se forment.
Dans les milieux sans auxine (5/0, 7,5/0 et 10/0), les cals se différencient en tiges et feuilles mais pas en racines. Il semble que plus la concentration en cytokinine est forte et plus l'apparition d'organe est importante avec des entre nœuds de taille réduite.
Dans les milieux 5/0, 5/5 et 5/7,5 il apparaît une diminution de la longueur des tiges et un phénomène de callogenèse.
Les milieux 7,5/0, 7,5/5 et 7,5/7,5 présentent, petit à petit, une diminution de la taille des tiges et du nombre de feuilles. Le matériel végétal montre une chlorose d’autant plus importante que le milieu est riche en ANA.
Enfin, les belladones cultivées sur les milieux 10/0, 10/5 et 10/7,5 montrent des feuilles petites, nombreuses et des tiges courtes dont le nombre et la taille diminuent avec l’augmentation de la concentration en auxine au profit d'une callogenèse.
La mandragore (figure 2) ne montre aucunes différences quel que soit l’équilibre en régulateur de croissance présent dans le milieu de culture. La mandragore ne s'est jamais différenciée et est restée à l'état de cal.
Figure 2 : Aspect de la mandragore au terme de la culture
D’après Prasad et al (2013), qui ont utilisés de la belladone cultivée in vitro dans le milieu MS (3 % de saccharose, 8 % d’agar-agar) sous une photopériode de 14 h/j, à 26 ± 2°C et sous 200 lux ; il apparaît que plus le milieu est supplémenté en auxine (0,2 et 0,3 mg/l), plus la longueur des racines et des tiges est importante et ce à 30 et 45jours.Lorsque le milieu est supplémenté en kinétine, qui est une cytokinine de synthèse, les auteurs observent une callogenèse et une légère formation de racine qui reste bien moindre que celle observée avec l'ANA. Les mesures de masse sèche confirment que la kinétine est le régulateur de croissance qui induit le plus la callogenèse. D'autres études citées dans cette publication proposent d'augmenter la température du milieu à 27°C pour obtenir une meilleur micropropagation.
Nos observations vont donc dans le même sens et nous pouvons mettre en avant le rôle de la BAP dans la formation de cal et son rôle dans la division des cellules, ainsi que dans l'inhibition du développement racinaire. L'auxine, quant à elle, est surtout impliquée dans la rhizogenèse et la croissance des tiges et des feuilles. Plus que le régulateur de croissance lui-même c'est surtout la balance hormonale qui est importante. Si le rapport cytokinine sur auxine est élevé, le développement se fera au profit de nouvelles pousses alors que si ce rapport est faible le développement se fera principalement au profit de la longueur des tiges et du développement des racines.
Nous pouvons éliminer, en fonction des chloroses, de la nécrose des cals un certain nombre de milieu comme les milieux 0/5, 0/7,5 et 7,5/7,5.
3.2 Concentrations en chlorophylles a, b et en caroténoïdes
3.2.1 la belladone
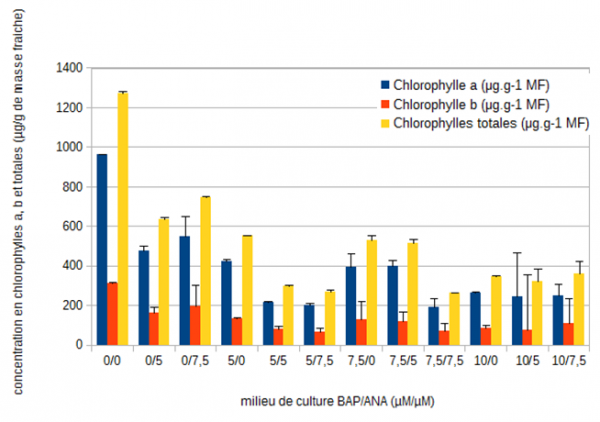
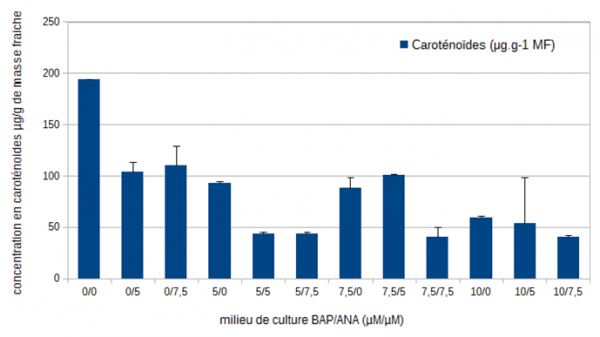
Pour la belladone cultivée sur les milieux sans auxine (0/0 – 5/0 – 7,5/0 – 10/0) une diminution des concentrations en chlorophylle a de 72 %, de 73 % pour la chlorophylle b et de 69 % pour les caroténoïdes est mesurée lorsque la concentration en BAP augmente de 0 à 10 µM (figure III et IV).
Figure 3 : Evolution des concentrations moyennes (µg/g de masse fraîche) en chlorophylles a, b et totales chez la belladone après 35 jours de culture en fonction des différents équilibres de régulateurs de croissance (6-benzyl aminopurine (µM)/ acide 1-naphtalène acétique (µM)).
Figure 4 : Evolution des concentrations moyennes en caroténoïdes (µg/g de masse fraîche) chez la belladone après 35 jours de culture en en fonction des différents équilibres de régulateurs de croissance (6-benzyl aminopurine (µM)/ acide 1-naphtalène acétique (µM)).
A l’inverse, lorsque la BAP est absente et que la concentration en ANA augmente, il semble y avoir une diminution (50,5 %) entre les milieux 0/0 et 0/5, avant qu’il y ait une augmentation (13,2 %) entre les milieux 0/5 et 0/7,5 pour la chlorophylle a. Cette même tendance est observée pour la chlorophylle b et les caroténoïdes avec respectivement une diminution de 48 % et 46 %, puis une augmentation de 18 % et 6,7 %.
De façon générale, lorsque la concentration de BAP est fixée à 5 µM et 7,5 µM et que la concentration d'ANA varie, les concentrations en chlorophylles a et b diminuent avec l'augmentation de la concentration d'auxine. Une diminution de 52 % en chlorophylle a et de 50 % en chlorophylle b est observée entre les milieux 5/0 et 5/7,5. Cette diminution est de 51 % en chlorophylle a et de 46 % en chlorophylle b entre les milieux 7,5/0 et 7,5/7,5. Concernant les caroténoïdes, une diminution de 53 % est observée lorsque la concentration en BAP est de 5 µM et que le milieu est supplémenté en ANA par rapport au milieu sans ANA. Mais lorsque celle-ci est de 7,5 µM, il apparaît une augmentation de 12 % puis une diminution de 60 % entre les milieux 7,5/0 – 7,5/5 et 7,5/7,5. En revanche, la variation entre les milieux 10/0 et 10/7,5 n'est pas nette d’autant plus que les écarts types sont importants.
Pour les chlorophylles totales, leur concentration est la plus importante dans le milieu 0/0 et c'est dans ce même milieu que la concentration en caroténoïdes est la plus élevée. Les concentrations les plus faibles en chlorophylles totales sont mesurées dans les milieux 5/5 – 5/7,5 et 7,5/7,5. C'est dans ces mêmes milieux ainsi que dans les milieux 5/5 et 10/7,5 que la concentration en caroténoïdes est la plus faible.
Najmeh et al (2010) ont cultivés des chevelus racinaires d'Atropa belladonna L. dans le milieu MS sans hormone en les exposant à différentes concentrations de nitrates. Ces auteurs ont montré qu’il existait une corrélation entre la production de scopolamine et l'activité photosynthétique. Ainsi, l'augmentation de la production de scopolamine est proportionnelle à l'augmentation de la concentration en chlorophylles a et b.
Le milieu 0/0 se distingue par sa plus forte concentration en chlorophylles totales (1274,51 µg/g). Il semblerait que plus la concentration en auxine augmente et plus la production de chlorophylles est diminuée. Pour les cytokinines, de 0 à 5 µM, une diminution des concentrations en pigments chlorophylliens est observée suivi d’une légère augmentation lorsque la concentration en BAP est de 7,5 µM avant de diminuer de nouveau.
3.2.2 la mandragore
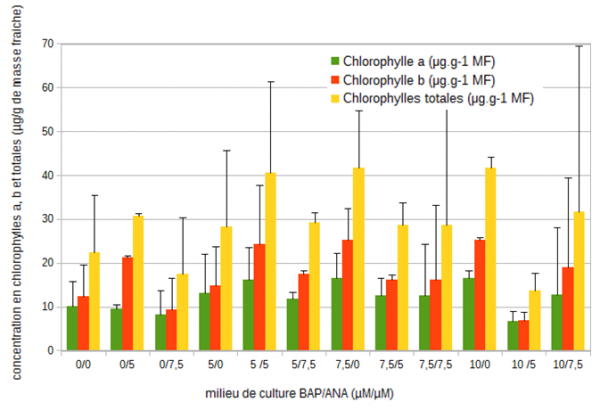
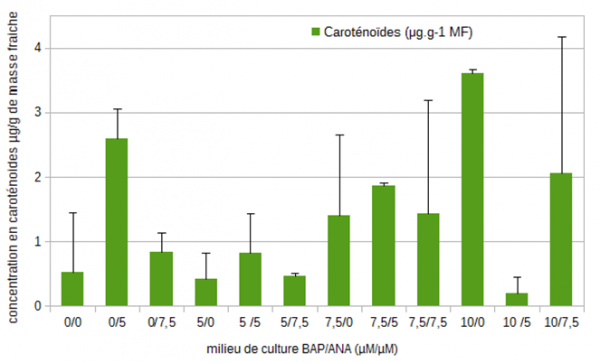
Les concentrations en pigments chlorophylliens chez la mandragore ne sont pas très élevées et sont comprises entre 6 et 16,6 µg/g pour la chlorophylle a, 6,9 et 24 µg/g pour la chlorophylle b et 2,6 µg/g pour les caroténoïdes (figures 5 et 6).
Figure 5 : Evolution des concentrations moyennes (µg/g de masse fraîche) en chlorophylles a, b et totales chez la mandragore après 35 jours de culture en fonction des différents équilibres de régulateurs de croissance (6-benzyl aminopurine (µM)/ acide 1-naphtalène acétique (µM)).
Figure 6 : Evolution des concentrations moyennes (µg/g de masse fraîche) en caroténoïdes chez la mandragore après 35 jours de culture en fonction des différents équilibres de régulateurs de croissance (6-benzyl aminopurine (µM)/ acide 1-naphtalène acétique (µM)).
Lorsque la concentration en cytokinine et nulle et que celle d'auxine augmente, une diminution de 20 % pour la chlorophylle a est mesurée, mais un pic à 21,24 µg/g pour la chlorophylle b et à 2,6 µg/g pour les caroténoïdes apparaît pour le milieu 0/5 (faisant suite respectivement à une variation de +42 % et -56 % pour la chlorophylle b et +80 % et -69 % pour les caroténoïdes entre les milieux 0/0 – 0/5 et 0/5 – 0/7,5). Les milieux 5/0 – 5/5 et 5/7,5 montrent des variations similaires. En revanche, dans les milieux où la concentration de BAP est fixée à 7,5 µM et où la concentration d'auxine augmente, les concentrations en chlorophylles a et b diminuent de 27 % et 36 % respectivement. A l'inverse, dans les milieux 10/0 – 10/5 et 10/7,5, la plus faible concentration en pigments est observée dans le milieu intermédiaire soit le milieu 10/5.
Dans les milieux sans auxine et lors de l'augmentation de la concentration en BAP, les concentrations en chlorophylles a, b et en caroténoïdes augmentent jusqu'à atteindre un certain pallier (16 µg/g, 25 µg/g et 3,6 µg/g respectivement pour la chlorophylle a, la chlorophylle b et les caroténoïdes). Lorsque la concentration d'auxine est de 5 µM et que la concentration de BAP augmente, il ne semble pas y avoir de corrélation, quel que soit le pigment chlorophyllien dosé. Il semble seulement qu'un maximum se dégage pour le milieu 5/5 mais les écarts types restent importants. Enfin, lorsque la concentration d'auxine est fixée à 7,5 µM, une tendance à l'augmentation de la concentration en pigments apparaît lorsque la concentration de cytokinine augmente. Il est assez difficile d'établir des conclusions nettes puisque les valeurs restent faibles et les écarts types importants. Les concentrations les plus fortes en chlorophylles totales sont produites avec les milieux 5/5 – 7,5/0 et 10/0. L'ensemble des pigments chlorophylliens semblent montrer un léger optimum de production lorsque la concentration d'auxine est de 5 µM et ce, quelle que soit celle de BAP. Lorsque la concentration d'auxine est fixe, les concentrations maximales en pigments chlorophylliens sont obtenues pour des concentrations de cytokinine proche de 7,5 ou 5 µM.
3.3 Concentration en protéines
3.3.1 dans la belladone en phase 1
Les dosages des protéines dans les belladones cultivées sur les milieux avec les douze balances hormonales (tableau 1) montrent que les concentrations varient entre 0,161 et 0,814 mg/ml pour les milieux 10/7,5 et 5/5 respectivement. Dans les milieux sans BAP (0/0 – 0/5 et 0/7,5), la concentration en protéines augmente avec l'augmentation de la concentration en ANA. Une augmentation de 6,28 % entre le milieu 0/0 et 0/7,5 est mesurée. Dans les milieux 5/0 - 5/5 et 5/7,5 il n’apparaît pas de relation entre l'augmentation de la concentration en protéines et celle en ANA, mais seulement un pic de 0,814 mg/mL pour le milieu 5/5. Enfin, dans les milieux 10/0 – 10/5 et 10/7,5, il y a une diminution de 64 % de la concentration en protéines avec l'augmentation de la concentration en auxine. Dans les milieux sans ANA (0/0 – 5/0 – 7,5/0 et 10/0), à l'exception du milieu 7,5/0 où il semble y avoir eu une erreur de manipulation, la concentration en protéines diminue avec l'augmentation de la concentration en BAP dans le milieu. Une diminution de 6,7 % entre le milieu 0/0 et 10/0 est observée.
Tableau 1 : Résultat du dosage des protéines totales par la méthode de Bradford chez la belladone cultivée sur les milieux MS avec douze équilibres de régulateurs de croissance (6-benzyl aminopurine / acide 1-naphtalène acétique (µM/µM)).
|
Milieu |
Concentration en protéines totales (mg/mL) |
|
0/0 |
0,481 |
|
0/5 |
0,507 |
|
0/7,5 |
0,513 |
|
5/0 |
0,474 |
|
5/5 |
0,814 |
|
5/7,5 |
0,367 |
|
7,5/0 |
0 |
|
7,5/5 |
0,515 |
|
7,5/7,5 |
0,336 |
|
10/0 |
0,449 |
|
10/5 |
0,316 |
|
10/7,5 |
0,161 |
3.3.2 la belladone en phase 2
Lors de la deuxième phase de la manipulation (tableau 2), si le milieu 0/0 est enrichi d'une concentration en AAS de 2.10-3 mmol/L, augmentation de 29 % de la concentration en protéines par rapport au milieu témoin est observée, alors que l'ajout d'ornithine dans le milieu 0/0 à une concentration de 2.10-3 mmol/L produit une augmentation de 53 %. C'est avec cette concentration en ornithine que la concentration en protéines est la plus importante.
Tableau 2 : Résultat du dosage des protéines totales par la méthode de Bradford, chez la belladone cultivée sur deux équilibres hormonaux (0/0 et 7,5/5) avec : un milieu témoin, un milieu avec de l'acide acétylsalicylique (AAS) et un milieu avec de l'ornithine.
|
Milieu hormonal |
Supplément milieu |
Concentration en protéines totales (mg/mL) |
|
0/0 |
témoin |
0,481 |
|
0/0 |
[AAS] =2*10-3 mmol/L |
0,682 |
|
0/0 |
[Ornithine] =2*10-3 mmol/L |
1,027 |
|
7,5/5 |
témoin |
0,515 |
|
7,5/5 |
[AAS] =2*10-3 mmol/L |
0,711 |
|
7,5/5 |
[Ornithine] =2*10-3 mmol/L |
0,743 |
|
7,5/5 |
[Ornithine] =2*10-2 mmol/L |
0,569 |
Dans le milieu 7,5/5, l'ajout d'AAS à une concentration de 2.10-3 mmol/L entraîne une augmentation de 27,5 % de la concentration en protéines par rapport au milieu témoin. L’ajout d’ornithine au milieu à une concentration de 2.10-3 mmol/L a un effet similaire sur l'augmentation de la concentration en protéines (30 %). En revanche, lorsque l'ornithine est ajoutée à une concentration de 2.10-2 mmol/L l'augmentation n'est plus que de 9,5 %.
En comparant l'apport d'ornithine à 2.10-3 mmol/L dans les milieux 0/0 et 7,5/5, il apparaît une augmentation de 53 % de la concentration en protéines totales dans le milieu 0/0, alors que cette augmentation n’est que de 30 % dans le milieu 7,5/5. L'influence de l'ajout du précurseur sur la concentration en protéines est moindre que celle de la balance hormonale.
3.3.3 dans la mandragore en phase 1
Les variations dans les concentrations en protéines dans la mandragore (tableau 3) sont moins nettes que chez la belladone. Certaines concentrations étaient tellement faibles qu'elles n'ont pas pu être mesurées ; elles varient de 0,01 à 0,078 mg/L.
Tableau 3 : Dosage des protéines totales par la méthode de Bradford chez la mandragore cultivée sur douze équilibres hormonaux.
|
Milieu BAP/ANA (µM) |
Concentration en protéines totales (mg/mL) |
|
0/0 |
0,078 |
|
0/5 |
0,052 |
|
0/7,5 |
0,005 |
|
5/0 |
0,029 |
|
5/5 |
0,015 |
|
5/7,5 |
0 |
|
7,5/0 |
0,063 |
|
7,5/5 |
0 |
|
7,5/7,5 |
0 |
|
10/0 |
0,011 |
|
10/5 |
0,012 |
|
10/7,5 |
0,027 |
Dans les milieux sans BAP (0/0 – 0/5 et 0/7,5), plus le milieu est riche en auxine, plus la concentration en protéines diminue. La diminution de la concentration en protéine est de 93 % entre le milieu 0/0 et 0/7,5. Dans les milieux sans ANA (0/0 – 5/0 – 7,5/0 et 10/0), les concentrations en protéines fluctuent et il n'y a pas de corrélation avec l'augmentation de la concentration en BAP. Dans la série de milieux 5/0 – 5/5 - 5/7,5 et 10/0 – 10/5 – 10/7,5, la concentration en protéines augmente parallèlement avec celle de ANA. L'augmentation est de 60 % dans le milieu 10/0 et 10/7,5.
En comparant les variations de concentrations observées chez la mandragore et chez la belladone, il apparaît que la concentration en protéines augmente de façon proportionnelle à celle de l'auxine en absence de cytokinine. Mais, lorsque la BAP est présente, la concentration en protéines augmente parallèlement à celle de l'auxine. Malheureusement, il n'y a pas dans la littérature de résultats de dosage des protéines, réalisés dans des conditions proches, pour permettre des comparaisons.
3.4 le potentiel osmotique
3.4.1 chez la belladone en phase 1
Il n’apparaît pas de corrélation entre l'augmentation de la concentration en auxine et la pression osmotique lorsque la cytokinine est constante (tableau 4). À l'inverse, quand la concentration d’auxine est fixée et que celle de cytokinine varie (soit les milieux 0/0 – 5/0 – 7,5/0 - 10/0 ou encore 5/0 – 5/5 – 7,5/5 - 10/5 et enfin 0/7,5 – 5/7,5 – 7,5/7,5 - 10/7,5), il semble y avoir une tendance à la diminution de la concentration osmotique lorsque la concentration de BAP augmente.
Tableau 4 : Résultat des mesures du potentiel osmotique chez la belladone cultivée sur le milieu MS avec les douze équilibres de régulateurs de croissance (6-benzyl aminopurine / acide 1-naphtalène acétique (µM/µM)).
|
Milieu (BAP/ANA) en µM |
Concentration osmotique ψs (MPa) |
|
0/0 |
-0,312 |
|
0/5 |
-0,397 |
|
0/7,5 |
-0,205 |
|
5/0 |
-0,192 |
|
5/5 |
-0,237 |
|
5/7,5 |
-0,175 |
|
7,5/0 |
-0,200 |
|
7,5/5 |
-0,162 |
|
7,5/7,5 |
-0,202 |
|
10/0 |
-0,177 |
|
10/5 |
-0,167 |
|
10/7,5 |
-0,220 |
3.4.2 dans la belladone en phase 2
Lorsque le milieu est supplémenté en AAS ou en ornithine les résultats (tableau 5) diffèrent selon que le milieu soit sans régulateur de croissance (0/0) ou avec (7,5/5). Dans le milieu 0/0, il apparaît une diminution de 8 % du potentiel osmotique lorsque le milieu est supplémenté en AAS à 2.10-3 mmol/L et une diminution de 10 % avec celui supplémenté en ornithine à la même concentration. En revanche, le milieu 7,5/5 montre une augmentation de 24,6 % lorsque celui-ci est supplémenté en AAS (à 2.10-3 mmol/L) et une augmentation de 60 % lorsqu'il est supplémenté en ornithine (à la même concentration). Malheureusement, il n’y a pas dans la littérature de données à des fins de comparaison de production des alcaloïdes tropaniques ou de stimulation du métabolisme secondaire.
Tableau 5 : Mesure du potentiel osmotique chez la belladone, sur deux équilibres hormonaux avec un milieu témoin, un milieu avec de l'acide acétylsalicylique (AAS) et un milieu avec de l'ornithine.
|
Milieu hormonal |
Supplément milieu |
Concentration osmotique ψs (MPa) |
|
0/0 |
témoin |
-0,312 |
|
0/0 |
[AAS] =2*10-3 mmol/L |
-0,287 |
|
0/0 |
[Ornithine] =2*10-3 mmol/L |
-0,280 |
|
7,5/5 |
témoin |
-0,162 |
|
7,5/5 |
[AAS] =2*10-3 mmol/L |
-0,215 |
|
7,5/5 |
[Ornithine] =2*10-3 mmol/L |
-0,412 |
3.5 Dosage des alcaloïdes tropaniques
3.5.1 dans la belladone pour la phase 1
Le milieu sans hormone est le milieu qui permet la plus forte production d’alcaloïdes tropaniques avec 3 460 ng/g de scopolamine et 3 880 ng/g d'atropine (tableau 6). Dans ce milieu, comme le développement racinaire était le plus important, un dosage a pu être réalisé sur les racines. C'est sur ce matériel végétal que ratio atropine/scopolamine apparaît le plus fort juste devant les cals cultivés sur les milieux 10/0 (15,45) et ceux du milieu 5/0 (13,39).
Tableau 6 : Dosage en CL-SM/SM des concentrations (ng/g) en atropine et en scopolamine de la belladone (feuille et cal) cultivée sur douze équilibres hormonaux différents, avec un pourcentage d'erreur de 20 %.
|
Équilibre BAP/ANA (µM/µM) |
Partie végétale prélevée |
Concentration (ng/g) scopolamine |
Concentration (ng/g) atropine |
Ratio : atropine/ scopolamine |
|
0/0 |
feuille |
3460 ± 692 |
3880 ± 776 |
1,12 |
|
racine |
129 ± 25,80 |
2340 ± 468 |
18,13 |
|
|
0/5 |
feuille |
2040 ± 408 |
2710 ± 542 |
1,32 |
|
cal |
2,38 ± 0,47 |
14,85 ± 2,97 |
6,23 |
|
|
0/7,5 |
feuille |
240 ± 48 |
180 ± 36 |
0,75 |
|
cal |
78 ± 15,60 |
120 ± 24 |
1,53 |
|
|
5/0 |
feuille |
16,30 ± 3,26 |
49,80 ± 9,96 |
3,05 |
|
cal |
3,77 ± 0,75 |
50,50 ± 10,10 |
13,39 |
|
|
5/5 |
feuille |
47,70 ± 9,54 |
26,10 ± 5,22 |
0,54 |
|
cal |
38,10 ± 7,63 |
21,65 ± 4,33 |
0,56 |
|
|
5/7,5 |
feuille |
23,90 ± 4,78 |
21,80 ± 4,36 |
0,91 |
|
cal |
2,64 ± 0,52 |
3,66 ± 0,73 |
1,39 |
|
|
7,5/0 |
feuille |
5,15 ± 1,03 |
4,37 ± 0,87 |
0,84 |
|
cal |
- |
6,21 ± 1,24 |
- |
|
|
7,5/5 |
feuille |
16,90 ± 3,38 |
22,20 ± 4,44 |
1,31 |
|
cal |
82 ± 16,40 |
46,85 ± 9,37 |
0,57 |
|
|
7,5/7,5 |
feuille |
11,50 ± 2,30 |
32,70 ± 6,54 |
2,84 |
|
cal |
1,84 ± 0,36 |
5,50 ± 1,10 |
2,98 |
|
|
10/0 |
feuille |
14,90 ± 2,98 |
14,30 ± 2,86 |
0,95 |
|
cal |
1,74 ± 0,34 |
26,90 ± 5,38 |
15,45 |
|
|
10/5 |
feuille |
141 ± 28,20 |
97,50 ± 19,50 |
0,69 |
|
cal |
9,15 ± 1,83 |
8,25 ± 1,65 |
0,90 |
|
|
10/7,5 |
feuille |
53 ± 10,60 |
44,80 ± 8,96 |
0,84 |
|
cal |
7,80 ± 1,56 |
11,20 ± 2,24 |
1,43 |
Lorsque la concentration en BAP est nulle et que celle d'auxine augmente, les concentrations en atropine et en scopolamine des feuilles diminuent alors que celle-ci augmente dans les cals. Concernant les feuilles dans les autres milieux où la concentration d'auxine varie tandis que celle de cytokinine est stable, il n'apparaît pas de relation entre la balance hormonale du milieu et les concentrations d'atropine et de scopolamine. La concentration en scopolamine présente un maximum lorsque la concentration en ANA est de 5 µM. Dans ce milieu, la concentration d'atropine en revanche ne semble pas présenter de relation bien nette. Dans les milieux où la concentration en BAP est fixée à 5 µM, la concentration en atropine diminue avec l'augmentation de la concentration en auxine. Dans celui où la concentration en BAP est fixe à 7,5µM la concentration en atropine augmente avec la concentration en auxine. Enfin, dans les milieux 10/0 – 10/5 et 10/7,5, de nouveau un pic de concentration d'atropine est observé quand la concentration d'auxine est de 5 µM.
En définitive, dans les feuilles, c'est lorsque la concentration en ANA est de 5 µM que les concentrations en atropine et scopolamine sont les plus faibles.
Pour les feuilles, en comparant les milieux avec une concentration d'auxine fixe et en faisant varier celle en BAP, il apparaît que la concentration en scopolamine diminue jusqu'à ce que celle de BAP soit de 7,5 µM avant de ré-augmenter. Cette même variation est observée pour la concentration en atropine pour une concentration en BAP très proche. Ainsi, les concentrations les plus faibles en atropine et scopolamine sont obtenues lorsque la concentration en BAP est de 7,5 µM.
Dans les cals, la concentration en scopolamine présente un pic pour les milieux à 5 µM d'auxine lorsque la concentration de cytokinine est fixe. En revanche, quand la concentration d'auxine est fixe et que celle de BAP varie, il ne semble pas y avoir de réelle relation.
L'atropine ne montre pas de variation qui semble être en relation avec les changements des concentrations de BAP et d'ANA du milieu. Il est uniquement possible de noter un pic de concentration lorsque la concentration d'auxine est de 5 µM pour le milieu 7,5/5. Les autres concentrations élevées en atropine dans les cals sont obtenues dans les milieux 0/7,5 et 5/0.
Une étude menée par Saunders et al (1998) cherche à comprendre pourquoi les cultures de cellules produisent moins de métabolites secondaires que les plantes entières. Ainsi, chez le tabac (Nicotiana tabacum L.), il a été montré, lorsqu'il y avait présence de racines, que la concentration dans les cals diminue. L'équipe observe que lorsque la concentration de kinétine augmente de 0,2 à 2,2 mg/L dans les cals, la concentration de nicotine diminue ; à l'inverse, celle dans les racines augmente. Toutefois, lorsque les explants sont pourvus de racines, l'augmentation de concentration en nicotine est corrélée à l'augmentation de concentration en kinétine
L'équipe de Zárate et al (1997) a étudié la distribution et le dosage des alcaloïdes tropaniques. Les dosages, effectués en CG-SM, ont été réalisés sur de la belladone sauvage (Atropa baetica) collectée dans le parc naturel du Grazalema au sud de l’Espagne. Les concentrations en atropine sont de 10,0 mg/g de masse de matière sèche (MMS) dans la racine principale et de 3,0 mg/g MMS dans les feuilles. Les valeurs de la scopolamine sont de 0,6 mg/g MMS dans la racine et de 0,4 mg/g MMS dans les feuilles.
L’essai de perte à la dessiccation a permis d’évaluer le pourcentage d'eau dans la plante cultivée in vitro à 95,43 %.
Ceci nous permet d’obtenir une concentration radiculaire (la rhizogenèse a eu lieu dans le milieu 0/0) de 0,051 mg/g MMS d'atropine et 0,0028 mg/g MMS de scopolamine. Pour ce même milieu, dans les feuilles, la concentration d'atropine est de 0,0849 mg/g MMS et de 0,0757 mg/g MMS pour la scopolamine.
Les concentrations en scopolamine et atropine obtenues dans notre expérimentation sont bien inférieures aux valeurs de la publication. Ainsi, dans les racines une concentration en atropine 196 fois plus faible que celle obtenue par l'équipe de Zárate et al. (1997) est observée. De même, la concentration en scopolamine dans la racine est 214 fois plus faible. Dans les feuilles, les concentrations en atropine et en scopolamine sont respectivement 35 et 5 fois plus faibles dans notre expérimentation.
Au cours de nos expérimentations, les plus fortes concentrations en alcaloïdes dans les cals sont obtenues dans le milieu 0/7,5. Ces concentrations sont de 0,198 µg/g MMF en alcaloïdes (scopolamine + atropine) dans les cals et, pour comparaison, de 0,42 µg/g MMF dans les feuilles.
L'explication la plus probable pour expliquer les très faibles concentrations en atropine et scopolamine peut provenir de biais lors de l'extraction et du coefficient d'extraction du solvant sur la plante qui n'est pas connu.
En intégrant 20 % d'erreurs aux résultats obtenus avec le milieu 0/0, la concentration dans les feuilles serait de 0,09 mg/g MMS de scopolamine et de 0,1 mg/g MMS d'atropine. La concentration dans les racines serait respectivement de 0,0033 mg/g MMS et de 0,06 mg/g MMS de scopolamine et d'atropine. Cependant, même en prenant en compte ce pourcentage d'erreur du aux manipulations, nos résultats restent toujours bien inférieurs à ceux de l'équipe de Zárate et al. (1997) avec dans les feuilles des concentrations en scopolamine et atropine respectivement 4 et 29 fois plus faibles. Les différences dans la racine sont encore plus marquées avec une concentration de scopolamine 178 fois plus faible et 163 fois plus faible pour l'atropine.
3.5.2 dans la belladone en phase 2
Les résultats présentés dans le tableau 7, montrent l’intérêt de rajouter dans le milieu de l'acide acétylsalicylique ou un précurseur de la biogenèse des alcaloïdes tropaniques (l'ornithine).
Tableau 7 : Concentration (ng/mL) d'atropine et de scopolamine de la belladone (feuille et cal) cultivée sur deux équilibres hormonaux différents (0/0 et 7,5/7,5) avec milieu témoin, présence d'ornithine ou d'acide acétylsalicylique (AAS) dans le milieu de culture, avec un pourcentage d'erreur de 20 %.
|
Type de milieu (µM/µM) |
Supplément milieu de culture (mmol/L) |
Partie végétale prélevée |
Concentration (ng/g) scopolamine 1 |
Concentration (ng/g) atropine 1 |
ratio : atropine/ scopolamine |
|
0/0 |
témoin |
feuille |
2900 ± 580 |
3860 ± 772 |
1,33 |
|
[Ornithine] =2*10-3 |
feuille |
2000 ± 400 |
2730 ± 546 |
1,36 |
|
|
[AAS] =2*10-3 |
feuille |
5000 ± 1000 |
5680 ± 1136 |
1,13 |
|
|
7,5/5 |
témoin |
feuille |
136 ± 27,2 |
197 ± 39,4 |
1,44 |
|
cal |
8,9 ± 1,7 |
9,6 ± 1,9 |
1,07 |
||
|
[Ornithine] =2*10-2 |
feuille |
438 ± 87,6 |
121 ± 24,2 |
0,27 |
|
|
[Ornithine] =2*10-3 |
feuille |
580 ± 116 |
163 ± 32,6 |
0,28 |
|
|
cal |
15,7 ± 3,1 |
9,4 ± 1,8 |
0,60 |
||
|
[AAS] =2*10-3 |
feuille |
980 ± 196 |
921 ± 184,2 |
0,93 |
|
|
cal |
58,5 ± 11,7 |
65,5 ± 13,1 |
1,11 |
Dans le milieu 0/0, contre toute attente, lorsque celui-ci est supplémenté en ornithine à la concentration de 2.10-3 mmol/L , une diminution de 31 % de la concentration de scopolamine et de 29 % de celle d'atropine est notée. En revanche, dans la situation où le milieu est supplémenté en AAS à une concentration de 2.10-3 mmol/L, des augmentations de 42 % de la concentration en scopolamine et de 32 % de celle d'atropine sont notées. Il faut souligner que les ratios atropine/scopolamine sont sensiblement conservés.
Dans le milieu 7,5/5, pour les feuilles, l'ornithine à la concentration de sont notées induit une augmentation de 76 % de la concentration de scopolamine alors qu'elle n'est que de 69 % lorsque l'ornithine est utilisée à une concentration de 2.10-2 mmol/L. La plus forte concentration en scopolamine dans les feuilles de belladone cultivée sur le milieu 7,5/5 est obtenue lorsque l'AAS est employé à une concentration de 2.10-3 mmol/L, induisant une augmentation de 86 % de la concentration en scopolamine par rapport au milieu témoin.
Cette augmentation de la concentration en scopolamine se reproduit dans les cals avec une augmentation de 43,3 % dans le milieu supplémenté à l'ornithine (2.10-3 mmol/L) par rapport au milieu témoin et de 84 % dans celui supplémenté avec de l'AAS (2.10-3 mmol/L).
Dans les feuilles, curieusement, la concentration en atropine diminue dans les milieux supplémentés avec de l'ornithine, par rapport au milieu témoin. Une diminution de 38 % est notée dans le milieu supplémenté en ornithine à une concentration 2.10-2 mmol/L ; cette diminution est de 17 % lorsque le milieu est supplémenté à une concentration de 2.10-3 mmol/L, par rapport au milieu témoin. En revanche, lors de l'ajout de l'AAS, une augmentation de 78 % de la concentration en atropine est notée.
Le dosage dans les cals ne montre pas de différence significative entre le milieu témoin et le milieu supplémenté avec de l'ornithine (à 2.10-3 mmol/L), par contre, la concentration obtenue avec le milieu supplémenté avec l'AAS est presque 7 fois plus élevée que celle du milieu témoin.
L'impact de l'acide acétylsalicylique sur la production des alcaloïdes tropaniques a été étudié par Lee et al. (2001) afin de déterminer la concentration d'AAS optimale pour la production de ces métabolites secondaires. Le matériel végétal était constitué des cultures racinaires de belladone en milieu MS avec 3 % de saccharose, à 25°C. À la concentration de 0,2 mM, il n'y a pas d'augmentation des alcaloïdes tropaniques totaux accumulés dans les tissus, alors qu'avec 2 mM d'AAS, leurs concentrations augmentent de 35 %. La concentration en alcaloïdes totaux atteint alors 0,8 % de la masse sèche dans la racine pour le milieu supplémenté avec 2 mM d'AAS et 0,28 % pour le milieu supplémenté avec 0,2 mM d'AAS.
Au cours de nos expérimentations, dans le milieu 0/0, une augmentation de 42 % de la concentration de scopolamine et 32 % de celle d'atropine est notée en présence d'AAS à la concentration de 2.10-3 mmol/L. Le pourcentage d'augmentation est donc similaire à celui observé par Lee et al.
Dans le milieu 7,5/5, à cette même concentration d'AAS, l'augmentation de la concentration dans les feuilles est de 86 % pour la scopolamine et de 78 % pour l'atropine. Dans les cals, des augmentations de 84 % et de 85 % sont observées respectivement pour la concentration de scopolamine et pour celle d'atropine.
L'augmentation dans les cals induite par l'ajout d'acide acétylsalicylique à une concentration de 2.10-3 mmol/L est la plus importante et est même supérieure à celle obtenue par l'équipe de Lee et al.
Concernant l'emploi de l'ornithine, Salonen et Simola (1989) suggèrent que, chez la belladone, le ratio scopolamine sur hyoscyamine présente une relation dose dépendante de la concentration d'ornithine. Ce phénomène est expliqué par la stimulation de la nitrate réductase.
À contrario, chez le tabac cultivé dans le milieu MS supplémenté avec différentes concentrations d'ornithine (2*10-3 et 2*10-4 mmol/L) et d'autres précurseurs, pendant 4 semaines de culture ; c'est à la dose de 2*10-4 mmol/L que la concentration en nicotine est la plus forte et qu'elle est augmentée de 2,14 % par rapport au milieu témoin. L'ajout d'autres précurseurs au milieu, comme la putrescine, ne stimulent que très faiblement cette production. (Ohta et al., 1978)
L'équipe de Nussbaumer et al. (1998) lors d'une expérimentation de culture de chevelus racinaires de datura (D. candida × D. aurea), dans le milieu de Gamborg B5, a montré qu'en ajoutant de l'ornithine, de la phénylalanine et de l'arginine, les taux de scopolamine et d'hyoscyamine sont modifiés. L'ornithine (testée à 0,25 et 0,50 mM) réduit spécifiquement la concentration de scopolamine alors que la phénylalanine et l'arginine augmentent la concentration de ces deux alcaloïdes.
Enfin, une étude sur des suspensions cellulaires de Datura stramonium indique que l'emploi simultané de phénylalanine et d'ornithine permet d'obtenir des concentrations en alcaloïdes tropaniques 5 fois plus élevées que dans le milieu témoin. L'équipe de Balica et al. (1993) a testé trois concentrations de précurseurs : 0,05 mM, 5 mM et 10 mM. C'est avec la plus forte concentration de précurseurs que la concentration en alcaloïdes totaux est obtenue avec 3,00 mg/g MMS contre 0,60 mg/g MMS pour le milieu témoin.
Lors de nos expérimentations, en comparant les deux milieux 0/0 et 7,5/5, il apparaît que l'acide acétylsalicylique exerce clairement un effet positif sur la production des alcaloïdes tropaniques. L'ornithine exerce également un effet positif mais uniquement sur la concentration en scopolamine dans le milieu 7,5/5. Dans toutes les autres configurations (c'est-à-dire dans les milieux 0/0 et 7,5/5 avec une concentration de 2*10-3 mmol/L et 2*10-2 mmol/L), l'ornithine exerce un effet négatif sur la production de scopolamine et d'atropine. Cet effet a été décrit par l'équipe de Nussbaumer et al (1998) mais est en contradiction avec celle de Balica et al (1993) qui stipule que la concentration en alcaloïdes tropaniques augmente de façon proportionnelle avec celle d'ornithine.
En conclusion, quel que soit le milieu et la concentration d'ornithine employée, la concentration d'atropine n'a pas pu être augmentée. En revanche, dans le milieu 7,5/5, une augmentation de la concentration en scopolamine est induite quelle que soit la dose d'ornithine ajoutée au milieu.
Remarque : un dosage des concentrations en scopolamine et en atropine a été réalisé deux fois. Il s'agit des feuilles dans le milieu 0/0 lors de la première phase de culture (tableau 14) et de ce même milieu lors de la deuxième phase (tableau 15). Dans le premier cas nous notons, respectivement, dans les feuilles, des concentrations en scopolamine et en atropine de 3 460 ± 692 ng/g et 3 880 ± 776 ng/g. Lors de la deuxième phase, la concentration en scopolamine est de 2 900 ± 580 ng/g et celle d'atropine de 3 860 ± 772 ng/g. Il apparaît que les concentrations d'atropine sont très proches mais en revanche, il faut tenir compte des 20 % d'erreurs liées aux manipulations pour pouvoir affirmer que la concentration en scopolamine est la même lorsqu'elle est mesurée dans les deux phases de culture. Cela montre (pour la concentration en scopolamine) qu'il y a au moins 16 % de variabilité de mesure lors d'un dosage.
3.5.3 dans la mandragore en phase 2
Le résultat du dosage chez la mandragore (tableau 8) est quelque peu décevant puisque ni scopolamine ni d'atropine n’ont pu être dosées. Les valeurs sont trop faibles pour être prises en compte, la mandragore semble avoir perdu les caractères lui permettant de produire les alcaloïdes tropaniques au fil des repiquages de culture in vitro. Une autre hypothèse serait qu'étant donné que les alcaloïdes tropaniques sont synthétisés dans des organes différenciés, en l’occurrence les racines, et que la mandragore reste à l’état de cal sans présenter de différenciation dans nos conditions de culture cela pourrait expliquer l’absence de scopolamine et d'atropine.
Tableau 8 : Concentration (ng/g) d'atropine et de scopolamine chez la mandragore cultivée sur milieu MS avec un milieu témoin, un milieu avec de l'ornithine et un milieu avec de l'acide acétylsalicylique (AAS) dans le milieu de culture.
|
Milieu de culture |
Supplément milieu de culture (mmol/L) |
concentration (ng/g) scopolamine 1 |
concentration (ng/g) atropine 1 |
|
MS |
témoin |
- |
- |
|
[Ornithine] =2*10-3 |
- |
6,51 ± 1,30 |
|
|
[AAS] =2*10-3 |
- |
1,09 ± 0,21 |
Conclusion
L'objectif de cette étude était de connaître quel serait un des milieux de culture le mieux adapté à la culture in vitro de la belladone et de la mandragore et de chercher à augmenter leur biogenèse des alcaloïdes tropaniques.
Chez la mandragore, les résultats ont été quelque peu décevant puisque celle-ci, cultivée à l'état de cal ne s'est jamais différenciée quel que soit l'équilibre de régulateurs de croissance dans le milieu. En revanche, chez la belladone, le milieu sans phytohormone a donné les meilleurs résultats dans la production des alcaloïdes tropaniques. La deuxième phase de culture avait pour objectif de tester l'impact de l'ornithine et de l'acide acétylsalicylique dans la production de scopolamine et d'atropine. Des augmentations de concentrations intéressantes ont pu être mises en évidence avec l'AAS. Mais l'emploi de l'ornithine reste à affiner car aux concentrations employées, une augmentation de la concentration en scopolamine a été notée dans le milieu 7,5/5 mais une diminution est apparue dans le milieu 0/0, alors que la concentration d'atropine, quant à elle est toujours réduite. Toutefois, les concentrations obtenues sont toujours très inférieures à celles décrites dans la littérature.
Chez Atropa belladonna, le dosage des chlorophylles avait clairement montré que le milieu 0/0 était le plus producteur en pigments donc potentiellement le plus bénéfique à l'activité photosynthétique des plantes. En revanche, ce n'est pas dans ce milieu que la concentration en protéines était la plus élevée. Toutefois, dans le milieu 0/0, le potentiel osmotique restait élevé et pouvait laisser entendre que la production en alcaloïdes tropaniques serait la plus prometteuse.
De très nombreux facteurs sont à prendre en compte pour augmenter la production des alcaloïdes tropaniques. Les études montrent que la concentration en sucre optimale est de 3 %, que la température de culture doit être de 25°C. Le temps de culture dans les conditions in vitro est également déterminant. En moyenne, 28 à 35 jours semble être le temps le plus optimal.
Bien qu'il existe de très nombreux milieux de cultures élaborés pour la culture in vitro, des expériences montrent que le rapport des ions NO3-/NH4+, ainsi que les phosphates ou encore les ions KNO3-, peuvent, s’ils sont rajoutés en quantité nécessaire, augmenter le taux des alcaloïdes totaux. (Mylona et al., 1981)
En plus des précurseurs utilisés comme l'ornithine, d'autres comme l'acide tropique et la tropine ont été utilisés avec succès chez des Solanacées producteurs d'alcaloïdes tropaniques. (Vu, 2008)
Enfin, des procédés sont mis au point pour augmenter la libération des composés issus du métabolisme secondaire comme la sonication ou l'électroporation.
Plus que la composition du milieu, le modèle végétal sélectionné a un rôle prépondérant. Par exemple certains modèles comme Camptotheca acuminata est parfaitement mis au point pour la production de camptothécine, pour des propriétés antitumorales (inhibiteur de la topoisomérase II). Il existe à ce titre comme spécialités pharmaceutiques le Topotécan® et l'irinotécan®. Les exemples sont encore nombreux comme le taxol de l'if (Taxus brevifolia) qui trouve également des applications pour ses propriétés anticancéreuses (Taxotère® ou Docétaxel). Dans ces deux exemples, le coût de production par la culture in vitro est bien plus avantageux que la récolte de la plante à l'état sauvage et évite également certain désastre écologique.
Ainsi, il reste de très nombreuses possibilités et perspectives pour augmenter la biogenèse des alcaloïdes tropaniques.