Modèles de Neuropathies Périphériques ChimioInduites (NPCI)
De nombreux agents de chimiothérapie utilisés dans le traitement des cancers ont pour effet secondaire d’induire des neuropathies périphériques. Plus de 60 % des patients sous chimiothérapie anticancéreuse développent des neuropathies. Ces dernières se manifestent principalement par des douleurs des membres débutant au cours de la chimiothérapie et persistant des mois, parfois des années après son arrêt. Ces douleurs peuvent devenir insupportables au point de justifier une réduction des doses voire un arrêt du traitement anticancéreux, diminuant ainsi les chances de survie du patient face au cancer.
Au quotidien, ces douleurs chroniques représentent une des causes majeures de l’altération de la qualité de vie des patients en cours de chimiothérapie et survivant au cancer, les plongeant dans la dépression ou l’anxiété. Malheureusement, aucun traitement n’existe pour prévenir leur survenue. Face à l’augmentation de nombreux cancers et l’amélioration de leur pronostic, il apparaît prioritaire de prévenir le développement des douleurs induites par la chimiothérapie.
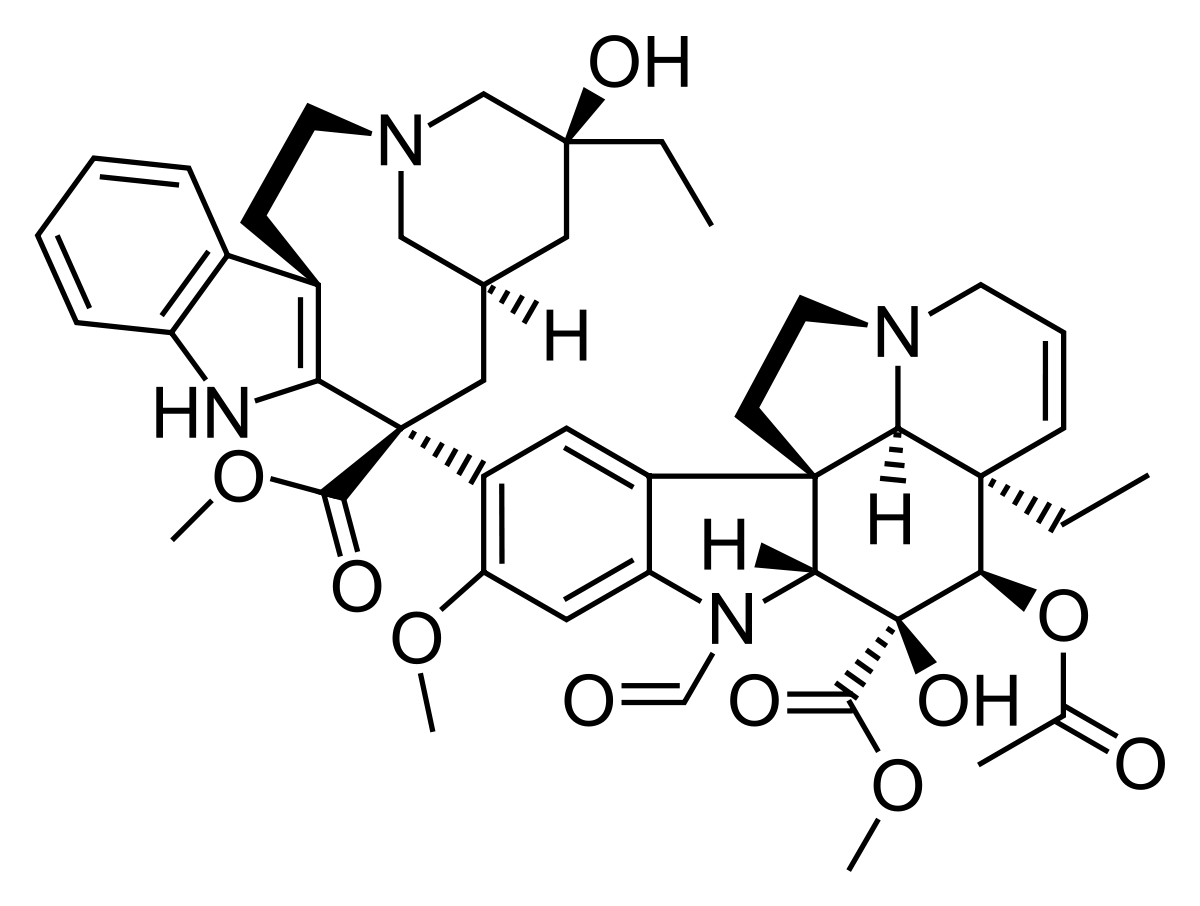
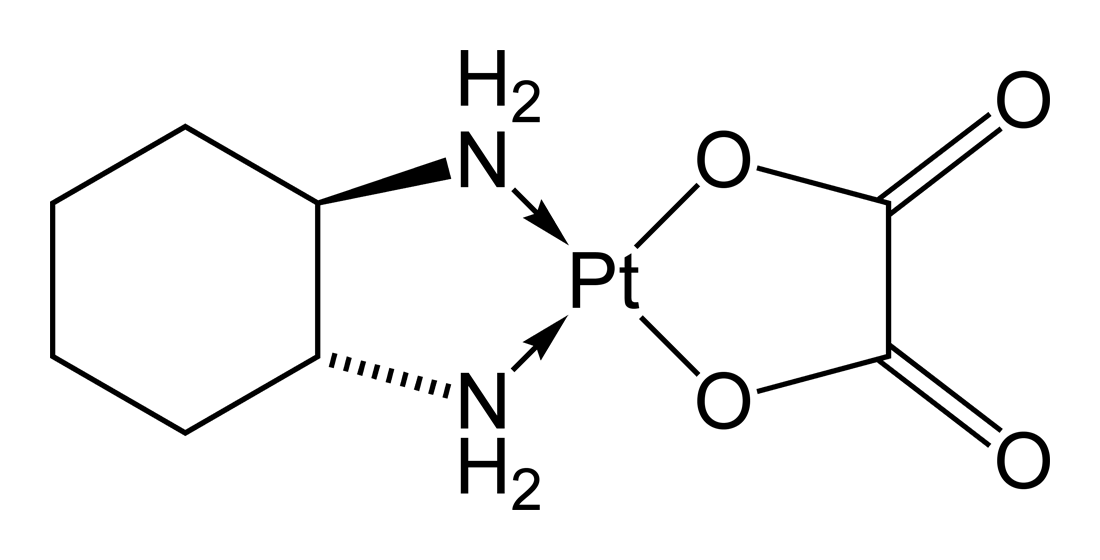
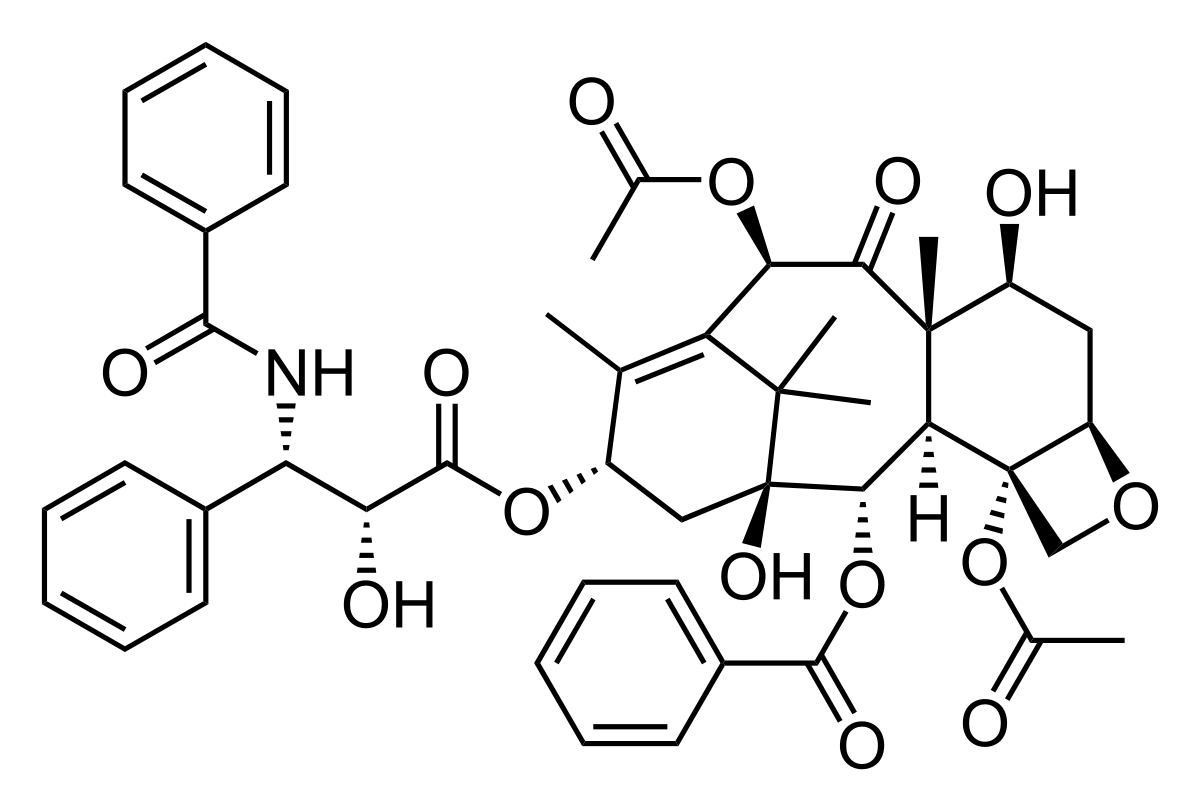
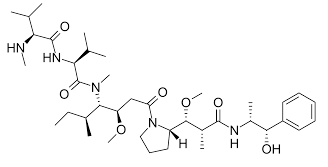
Plusieurs modèles murins de NPCI ont été développés : Modèle vincristine (VCR), oxaliplatine (OXA) et paclitaxel (PTX), chacun représentant une classe thérapeutique d’anticancéreux neurotoxiques, mais aussi un modèle MMAE (Monométhyl-Auristatine E), molécule souvent retrouvé dans les conjugués anticorps-médicaments (ADC).
Chaire d'excellence
Chaire d’excellence : Neuropathies Périphériques Induites par la Chimiothérapie – NPIC
Claire DEMIOT et Laurent MAGY sont responsables de la chaire d’excellence Neuropathies périphériques induites par la Chimiothérapie.
Claire DEMIOT est Pharmacien, MCU-HC Service de Pharmacologie, UFR Pharmacie de Limoges, UR20218 NEURIT
Laurent MAGY est Neurologue, PU-PH Centre de Référence des Neuropathies Périphérique, Service de Neurologie, CHU de Limoges, UR20218 NEURIT.
Face à l’augmentation de nombreux cancers et l’amélioration de leur pronostic, il apparaît prioritaire de prévenir le développement de douleurs induites par la chimiothérapie. Trouver un traitement pour prévenir leur survenue et améliorer l’accompagnement des patients par la mise en place de programme d’écucation thérapeutique, ce sont les objectifs de la recherche au sein de cette chaire d’excellence.
Modèle Vincristine (VCR)
La VCR est le plus neurotoxique des vinca-alcaloïdes que l’on rencontre parmi l’arsenal des agents anticancéreux qui sont utilisés en clinique humaine. Elle est indiquée notamment dans le traitement des cancers de l’enfant, des leucémies aigües lymphoïdes et des lymphomes non hodgkiniens. La neuropathie induite par la VCR (NPIV) touche 30 à 40% des patients et représente donc un enjeu de santé publique. Chez l’Homme, la NPIV est une polyneuropathie à prédominance sensitive et dose-dépendante induisant des paresthésie, des hyperalgésies et des allodynies tactiles. Un modèle animal de NPIV a été développé et caractérisé au sein de l’équipe, il présente des caractéristiques communes avec la pathologie humaine. Ce modèle a été la base pour les preuves de concept de l’effet de thérapeutique innovantes.
Modèle Oxaliplatine (OXP)
L’OXP figure également parmi les plus neurotoxiques des agents anticancéreux utilisés dans l’arsenal de la clinique humaine. C’est un agent anti-tumoral dérivé des sels de platine, il est utilisé principalement dans la prise en charge des cancers colorectaux. L’administration d’OXP peut générer des troubles neurologiques de façon aigüe, juste après ou même pendant l’injection, ou de façon chronique en cas de cumul de doses. L’OXP induit une neuropathie périphérique sensitive accompagnée ou non de crampes, souvent déclenchées par le froid. 95% des patients traités peuvent voire ces symptômes apparaitre. Le modèle murin de neuropathie induite par l’OXP, mis au point et caractérisé par analyse fonctionnelle et morphologique, reproduit les symptômes observés en clinique humaine.
Modèle Paclitaxel (PTX)
Le PTX est l’agent anti-cancéreux dont l’incidence de développement de neuropathies périphériques est la plus élevée. Molécule de première intention dans le traitement du cancer de l’ovaire, il est également utilisé dans le traitement des cancers du sein et du poumon. Le PTX est un poison du fuseau qui agit par inhibition de la dépolymérisation des microtubules. Environ 70% des patients traités par cette molécule sont touchés par la neuropathie induite par le paclitaxel (NPIP). Les symptômes se manifestent le plus souvent par des picotements, des fourmillements et des douleurs qui se développent de façon longueur-dépendant et peuvent, dans certains cas, être irréversible. Un modèle murin de NPIP est actuellement en cours de développement.
Monométhyl Auristatine E (MMAE)
Les conjugués anticorps-médicaments (ADC) sont de nouveaux médicaments anticancéreux composés d’un anticorps monoclonal (mAb) qui cible des antigènes tumoraux sélectifs, auquel est associé un agent cytotoxique très puissant à l’aide d’un lien chimique, souvent la monométhyl Auristaine E (MMAE). Cette stratégie permet un ciblage plus spécifique de la charge cytotoxique vers les cellules tumorales, améliorant ainsi l’efficacité et diminuant la toxicité systémique. De manière innattendue, les ADC ont été impliqués dans plusieurs toxicités non liées à l’antigène ciblé, telles que des toxicités oculaires, des neutropénies et des neuropathies. Le MMAE est un inhibiteur de la polymérisation de la tubuline, agent cytotoxique actuellement utilisé dans les ADC pour le traitement de certains lymphomes. Ces MMAE-ADC sont responsables de toxicités nerveuses périphériques. A ce jour, aucun modèle animal de neuropathie périphérique induite par le MMAE-ADC n’a été publié.
Analyses transcriptomiques
Nous avons également commencer à explorer les voies physiopathologique impliquées dans la neurotoxicité sur les DRG des modèles VCR, OXA et PTX par analyses transcriptomiques, afin de déterminer les voies de neurotoxicités communes et spécifiques de ces agents anticancéreux. Ces travaux nous donnent des indications précieuses sur l’étiologie de NPIC et sur les mécanismes physiopatholoiques impliqués. Grace à ces données précieuses, de nouvelles cibles thérapeutiques ont pu être découvertes.
Quelques articles représentatifs
– A mouse model of sensory neuropathy induced by a long course oh monomethyl-auristatin E treatment. Frachet et al. Toxicol Appl Pharmacol. 2023 Sep 1:474:116624. PMID: 37419214
– The Cholecystokinin type 2 receptor, a pharmacological target for pain management. Bernard et al. Phermaceuticals (Basel). 2021 Nov 19;14(11):1185. PMID 34832967
– Ramipril alleviates oxaliplatin-induced acute pain syndrome in mice. Bouchenaki et al. Front Pharmacol. 2021 Jul 19;12:712442. PMID : 34349658
– An overview of ongoing clinical trials assessing pharmacological therapeutic strategies to manage chemotherapy-induced peripheral neuropathy, based on preclinical studies in rodent models. Bouchenaki et al. Fundam Clin Pharmacol. 2021 Jun;35(3):506-523. PMID: 33107619
– The Angiotensin II Type 2 Receptor, a Target for Protection and Regeneration of the Peripheral Nervous System? Danigo et al. Pharmaceuticals (Basel). 2021 Feb 24;14(3):175. PMID: 33668331
– Neuroprotective effect of angiotensin II type 2 receptor stimulation in vincristine-induced mechanical allodynia. Bessaguet et al. Pain. 2018 Dec;159(12):2538-2546. PMID: 30086116
– Candersartan prevents resiniferatoxin-induced sensory small-fiber neuropathy in mice by promoting angitensin II-mediated AT2 receptor stimulation. Bessaguet et al. Neuropharmacology. 2017 Nov;126:142-150. PMID: 28882562