L'éthylène apporte n = 2 carbones sp2 qui fournissent chacun 1 électron π. Il y a donc 2 orbitales moléculaires π dont seule la première est occupée.
D'après la formule de Coulson, les valeurs propres sont :
λ1 = 2 cos π / 3 = 1 λ2 = 2 cos 2 π / 3 = -1
D'où le diagramme des niveaux d'énergie :
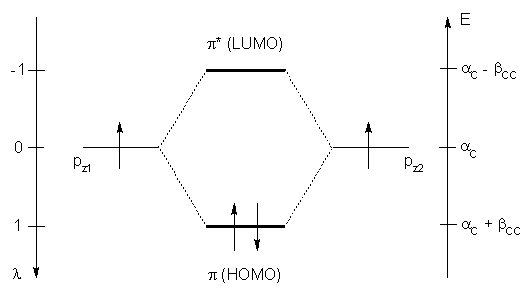 |
L'énergie des électrons π de l'éthylène est donc :
Eπ = 2 (αC + βCC)
-
L'azulène apporte 10 carbones sp2 qui fournissent chacun 1 électron π. Il y a donc 10 orbitales moléculaires π dont seules les 5 premières sont occupées.
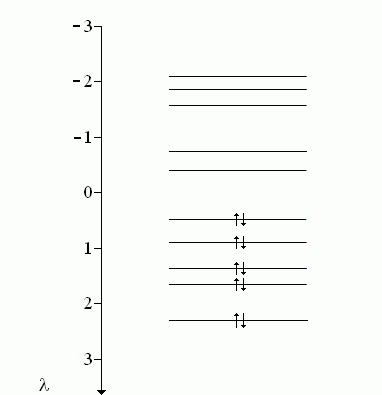
L'énergie des électrons π de l'azulène est donc :
Eπ = 2 (αC + 2,31 βCC) + 2 (αC + 1,65 βCC) + 2 (αC + 1,36 βCC) + 2 (αC + 0,89 βCC) + 2 (αC + 0,48 βCC) = 10 αC + 13,38 βCC
L'énergie de 5 éthylènes est : 10 αC + 10 βCC
L'énergie de résonance est donc :
ER = Eπ - (10 αC + 10 βCC) = 3,38 βCC
Comme βCC < 0, ER < 0 : l'azulène est bien stabilisé par résonance. Ceci est en accord avec le fait que toutes les orbitales liantes (λ > 0) sont occupées.
-
L'azulène réagit comme nucléophile. C'est donc l'orbitale HOMO qu'il faut considérer en priorité.
-
L'orbitale HOMO a ses plus forts coefficients (en valeur absolue) sur les carbones 1 et 3 : il s'agit donc des carbones les plus réactifs.
-
On ajoute 3 constantes magiques : 1 pour chaque cycle aromatique et 1 pour 2 cycles accolés.
log P = 10 f(C) + 8 f(H) + 3 CM = 10 × 0,110 + 8 × 0,204 + 3 × 0,219 = 3,39
soit une légère surestimation par rapport à la valeur expérimentale.
On a : pKa = - log (1,06 × 10-3) = 2,97 et P = 102,24 = 174
D'où l'expression du coefficient de distribution :
D = P / (1 + 10pH - pKa) = 174 / (1 + 10pH - 2,97)
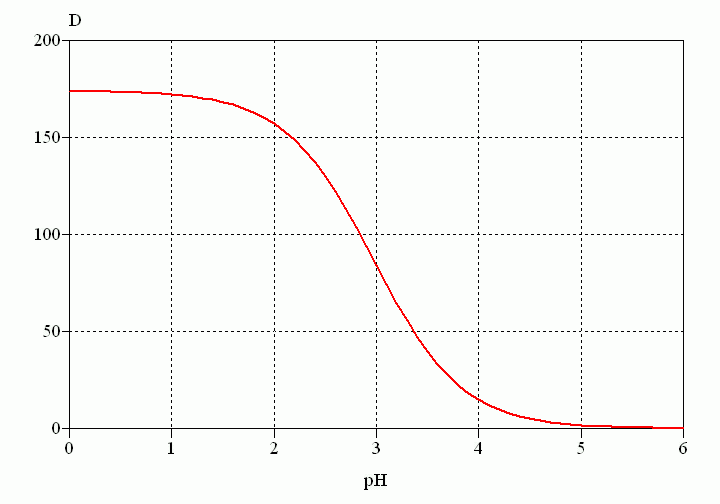 |
On veut D / P = 0,9, d'où :
1 / (1 + 10pH - 2,97) = 0,9
10pH - 2,97 = 1 / 0,9 - 1 = 0,111
pH = 2,97 + log 0,111 = 2