Pour chaque diène, l'interaction privilégiée se fait entre l'orbitale HOMO du diène (nucléophile) et l'orbitale LUMO de l'anhydride maléique (électrophile). En effet cette interaction correspond à la plus faible différence d'énergie ΔE entre HOMO et LUMO.
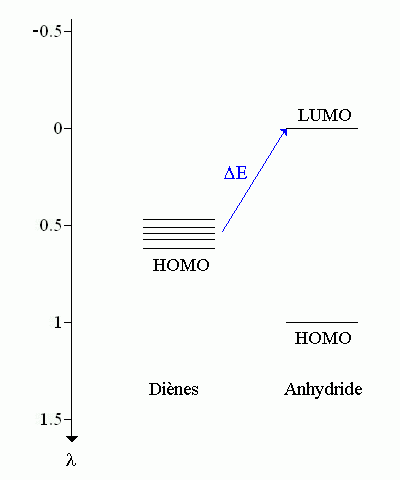 |
ΔE / βCC = λ HOMO (diène) - λ LUMO (anhydride) = λ HOMO (diène) - 0 = λ HOMO (diène)
L'équation de la droite de régression est :
log k = (-0,04 ± 0,76) - (6,6 ± 1,4) (ΔE / βCC)
r2 = 0,88 ; s = 0,16 ; F = 22,5
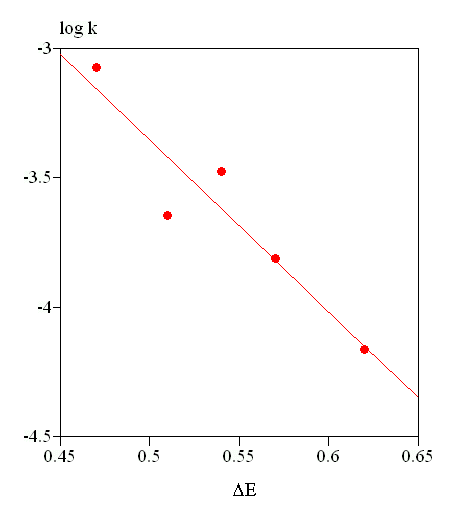 |
On peut donc considérer que le terme ΔE rend compte de 88% des variations de log k. Bien que les points ne soient pas très bien alignés, le résultat est acceptable compte tenu des approximations utilisées dans la méthode de Hückel.
La théorie des orbitales frontières permet d'interpréter la formation de l'état de transition. Il s'agit donc de la réactivité cinétique. ΔE peut être considérée comme une approximation de l'énergie d'activation.