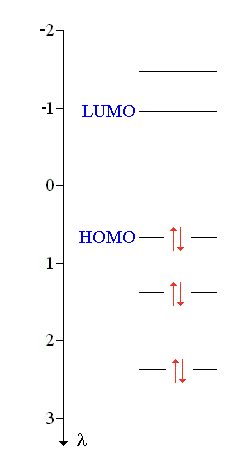
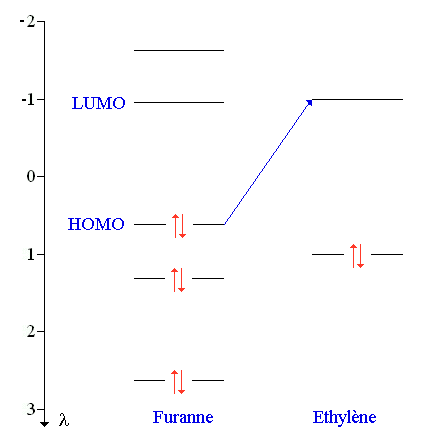
Les diagrammes d'énergie du furanne et de l'éthylène sont représentés sur la figure suivante :
 |
L'énergie des électrons π du furanne est donc :
Eπ = 2 (αC + 2,63 βCC) + 2 (αC + 1,31 βCC) + 2 (αC + 0,62 βCC) = 6 αC + 9,12 βCC
L'interaction la plus favorable met en jeu l'orbitale HOMO du furanne et l'orbitale LUMO de l'éthylène. En effet c'est celle qui correspond à la plus faible différence d'énergie entre HOMO et LUMO.
Les carbones 2 et 5 du furanne vont réagir préférentiellement car ils ont les plus forts coefficients (en valeur absolue) dans l'orbitale HOMO.
Les signes des fonctions d'onde sont les mêmes sur les atomes qui réagissent : la formation de l'état de transition est donc possible.