Les auteurs dressent un bilan des recherches qu’ils ont effectuées depuis 1970 sur plusieurs espèces de Lymnaeidae dans le Limousin afin de déterminer leur rôle comme hôtes intermédiaires dans la transmission de la fasciolose humaine, de préciser plusieurs points dans le développement larvaire du parasite chez ces mollusques et de mettre au place un contrôle contre la limnée la plus fréquente, Galba truncatula. La fasciolose a fortement reculé dans la région depuis les années 2000 en raison de l’abandon du cresson « sauvage » dans la consommation humaine. Plusieurs espèces de limnées ont été identifiées dans ces cressonnières et trois modes d’infestation par Fasciola hepatica ont été mis en évidence. Chez G. truncatula, plusieurs générations rédiennes se succèdent dans le temps. La production de cercaires présente une variabilité en fonction des populations de limnées et également à l’intérieur d’une même population. Lors de l’évolution des formes larvaires du parasite, la limnée présente une pathologie au niveau de ses viscères. Dans les prairies sur sol acide, trois espèces d'escargots peuvent y vivre avec des caractéristiques propres pour chaque limnée. Deux types de contrôle pour G. truncatula ont été étudiés, l’un biologique basé sur des escargots prédateurs (Zonitoides nitidus) au début de l’assèchement estival, et l’autre intégré prenant en compte les différentes mesures connues pour déparasiter l’hôte définitif et éliminer la limnée. Les résultats obtenus lors de l’étude de ces différents thèmes sont analysés et plusieurs hypothèses de travail sont proposées pour les chercheurs à venir.
The authors take stock of the research they have carried out since 1970 on several species of Lymnaeidae in Limousin to determine their role as intermediate hosts in the transmission of human fasciolosis, to specify several points in the larval development of the parasite in these species. and to develop a control against the most common lymnaeid, Galba truncatula. Fasciolosis has declined sharply in the region since the 2000s due to the abandonment of "wild" watercress in human consumption. Several species of lymnaeids were identified in these watercress beds and three modes of snail infection with Fasciola hepatica were highlighted. In G. truncatula, several generations of rediae succeeded one another in time. In this species, the production of cercariae varied according to the lymnaeid population and also within the same population. During the development of parasite larval forms, the snail showed tissue lesions in its viscera. In the meadows on acid soil, three species of snails can live there with specific characteristics for each lymnaeid. Two types of control for G. truncatula were studied, one being biological with the use of predatory snails (Zonitoides nitidus) at the beginning of the summer drying, and the other integrated taking into account the various known measures to deworm the definitive host and eliminate the lymnaeid.. The results obtained during the study of these different themes are analyzed and several working hypotheses are proposed for future researchers.
1. Introduction
La distomatose à Fasciola hepatica, encore appelée fasciolose ou maladie de la Grande Douve du foie, est une parasitose de mauvaise renommée. La distribution de cette affection est mondiale et la maladie se rencontre essentiellement dans les pays où le climat est tempéré (Torgerson et Claxton, 1999). Mais les importations de bétail dans d’autres pays comme en Egypte (Lofty et al., 2002 ; Periago et al., 2008 ; Dar et al., 2012) ou en Amérique du Sud (Mas-Coma et al., 2009a) se sont traduites par l’introduction du parasite. Le cycle biologique de ce dernier est complexe car il fait intervenir un mollusque d’eau douce (une limnée) qui assure le développement des formes larvaires. Lorsque l’œuf pondu par le parasite adulte est excrété avec les fèces de l’hôte définitif (bovins, ovins, …) dans le milieu extérieur et que les conditions sont favorables, il en sort un miracidium qui pénètre chez la limnée. Trois stades larvaires successifs : sporocyste, rédie et cercaire, se développent ensuite chez cette dernière pour aboutir à la sortie de cercaires libres à partir du mollusque hôte. Cette cercaire nage quelques minutes dans l’eau avant de se fixer sur une plante et se transformer en métacercaire. C’est cette dernière qui constituera la forme infectante et contaminera un nouvel hôte définitif si elle est ingérée avec la végétation. Elle se développe en une forme immature qui migre dans le parenchyme et devient adulte en se fixant dans le foie de ce nouvel hôte (Taylor, 1965 ; Andrews, 1999). Plusieurs espèces de limnées peuvent assurer le développement larvaire complet du parasite mais l’espèce la plus commune en Europe est Galba truncatula, connu aussi sous le nom de Limnée épaulée (Gargominy et al., 2011) ou de Limnée tronquée. D’autres limnées comme Omphiscola glabra (la Limnée étroite en français) peuvent également assurer ce développement larvaire à des degrés divers (Dreyfuss et al., 2015b ; Vignoles et al., 2017, 2018).
Dans le passé, cette parasitose a été à l’origine de nombreuses épizooties chez les ruminants domestiques sur le territoire français. Le premier auteur à signaler le danger des endroits marécageux (là où vivent les limnées) dans la survenue de la maladie chez les moutons fut de Brie (1379). Par la suite, les troupeaux d’ovins dans plusieurs régions françaises ont été régulièrement décimés par cette parasitose entre 1742 et 1854 comme le rapportent Neumann et MacQueen (1905). D’autres épizooties ont également été décrites par la suite comme celle survenue en 1910 dans le département de l’Indre (Baron, 2014, 2015). La survenue de pluies abondantes au cours de l’année est souvent à l’origine de ces épizooties car elle permet le développement de trois populations de limnées (au lieu de deux généralement lors d’une année normale) et, par suite, de nombreuses émissions cercariennes (Euzeby, 1971). Cette notion de pluviométrie comme facteur précédant la survenue de la fasciolose dans une région avait déjà été relevée par les auteurs dans le passé (voir les revues de Vallat, 2001 et de Baron, 2014). Elle est toujours d’actualité car elle est encore utilisée pour prévoir le risque de cette parasitose dans une région ou un pays donné depuis les travaux d’Ollerenshaw en Grande-Bretagne (Ollerenshaw et Smith, 1969 ; Ollerenshaw, 1971a, b). L’homme n’est pas en reste vis-à-vis de la fasciolose et certaines bouffées épidémiques en France ont frappé plus d’une centaine de personnes dans le passé (Houin, 2009). Une enquête réalisée par Gaillet (1983) a, d’ailleurs montré que 10.000 cas humains environ avaient été diagnostiqués en France depuis 1956 jusqu’en 1982. Même si la fasciolose humaine a diminué en fréquence depuis plus d’une cinquantaine d’années, des épidémies sont toujours possibles comme celles qui ont été rapportées dans la Somme en 1988 (Chandenier et al., 1989) ou dans la région Nord–Pas-de-Calais en 2002 (Institut de Veille Sanitaire, 2003).
Dans le sud de la Vienne et le nord de la Haute-Vienne, une épizootie de fasciolose a entraîné en 1969 la mort de 250.000 moutons et d’une cinquantaine de bovins (Duret, 1969). De même, plus de 150 personnes habitant la Corrèze, la Creuse, la Haute-Vienne ou un département limitrophe ont été touchées par la maladie en 1968 ou en 1969 (Rondelaud et al., 2000, 2009a). Les conséquences économiques de cette épizootie et l’ampleur de la distomatose humaine ont été telles qu’elles ont conduit les éleveurs locaux, les élus, les professionnels de la santé et des chercheurs de l’Université de Limoges à se regrouper et à créer l’Institut de Pathologie Comparée et Expérimentale du Limousin dont l’axe principal de recherche était alors centré sur la fasciolose. Trois thèmes furent alors définis : a) l’étude épidémiologique de la maladie humaine dans la région, b) des travaux fondamentaux pour comprendre le développement des formes larvaires de F. hepatica chez les espèces locales de limnées, et c) la mise au point d’un contrôle de ces mollusques basé sur des agents biologiques (Rondelaud et al., 2009a). De nombreux travaux matérialisés par des publications scientifiques et des thèses de Doctorat ont été effectués sur ces trois thèmes au cours des 50 dernières années. Il nous a paru utile, au terme de cette période, de dresser un bilan sur les études que les chercheurs de trois laboratoires : Biologie Animale (Faculté des Sciences de Limoges), Histologie (Faculté de Médecine) et Parasitologie (Faculté de Pharmacie) ont effectuées sur ces trois thèmes. Comme cette maladie touche l’homme comme les animaux, certaines de ces recherches ont également été étendues aux ruminants locaux ainsi qu’aux prairies dans lesquelles ces animaux pâturent.
2. La fasciolose humaine
2.1. Distribution des cas dans le Limousin
Une enquête épidémiologique a été réalisée pendant 37 années (1970-2006) afin de colliger les personnes qui ont été touchées par la maladie entre 1955 et 2006 à la suite de la consommation d’une plante contaminée par les métacercaires de F. hepatica. Les résultats ont été rapportés dans plusieurs publications (Rondelaud, 1980a, 1987 ; Rondelaud et al., 1982, 2000, 2006a ; Szymkowiak, 1999 ; Szymkowiak et al., 2000). Au total, 863 patients ont été recensés au cours de la période précitée dans le Limousin ou un autre département français voisin de celui-ci. Sur cet échantillon, 721 ont été retrouvées et 621 ont accepté de répondre à un questionnaire précisant la date et les conditions du repas infestant, la fréquence de consommation par rapport à des plantes récoltées dans le milieu naturel, le nom de la plante consommée et son lieu d’origine. Ce questionnaire comportait également des demandes d’information sur les symptômes que ces patients ont présentés lors de l’apparition de la maladie et après l’application du traitement anthelminthique.
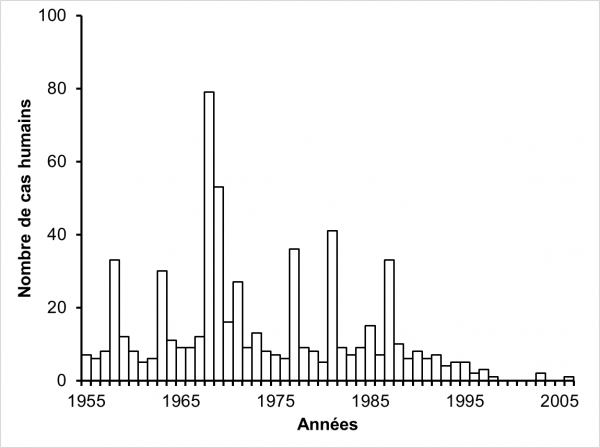
Figure 1 : Distribution numérique de 619 personnes touches par la fasciolose dans la région du Limousin entre 1955 et 2006. D’après Rondelaud et al. (2000).
La figure 1 montre la distribution annuelle des cas humains sur la période allant de 1955 à 2006. Soixante-quatre personnes ont été exclus de cet échantillon car elles avaient acheté ou récolté la plante infestée à l’extérieur du Limousin si bien que 619 seulement ont été considérées pour construire cette figure. Ces valeurs sont présentées par rapport à la date du repas infestant. Jusqu’en 1987, le nombre de patients touchés par la fasciolose montre des fluctuations irrégulières et des pics s’observent en 1958, 1963, 1968, 1969, 1971, 1977, 1981 et 1987. A partir de cette dernière date, on note une diminution progressive jusqu’en 1998 où deux cas ont seulement été diagnostiqués. Par la suite, le nombre de cas est très faible jusqu’en 2006 (trois cas seulement sur cette période). La lecture de ce graphe montre une diminution significative dans le nombre des cas humains dans le Limousin, surtout marquée à partir de 1998. D’après Rondelaud et al. (2000), cette diminution dans le nombre de cas humains serait due à la migration des jeunes issus des communes rurales vers les villes les plus proches pour y travailler ou faire leurs études et, par suite, au changement dans leurs habitudes alimentaires. Deux autres hypothèses, peut-être complémentaires de l’explication précédente, peuvent aussi être proposées : a) la disparition progressive de la génération des seniors âgés de 80 ans et plus, car ces personnes étaient souvent à l’origine des cas familiaux (plusieurs personnes touchées dans une même famille) en raison de leur consommation répétée de cresson au cours de l’année ; b) la diminution graduelle de la fasciolose animale chez les ruminants domestiques depuis les années 2000, date où les éleveurs ont utilisé de plus en plus un anthelminthique spécifique contre F. hepatica (triclabendazole) au lieu des molécules à large spectre utilisées dans les années antérieures (Reynal, 2001).
2.2. Le problème des cressonnières naturelles
Plusieurs espèces de plantes « sauvages » ont été consommées par les personnes qui ont été affectées par la fasciolose. Ces plantes étaient contaminées par les métacercaires du parasite si bien que ces larves, après l’ingestion de la plante par ces personnes, ont pu sortir de leur kyste et se différencier pour se transformer à terme en formes adultes. Le tableau I montre la distribution numérique de 616 patients en fonction de l’espèce végétale qu’ils avaient consommée. Pour construire ce tableau, deux périodes : de 1955 à 1980 et de 1981 à 1998, ont été considérées afin de montrer l’évolution qui existe dans la consommation de ces plantes contaminées en fonction du temps (Rondelaud et al., 2000). Le cresson de fontaine (Nasturtium officinale) est la plante qui a été le plus consommée par ces personnes. On note, cependant, un changement dans la consommation de ces plantes contaminées en fonction du temps. En effet, deux espèces de Nasturtium et deux autres de Rorippa (connues localement sous le nom de « cresson sauvage ») ont été incriminées par les patients avant 1980 car Nasturtium et Rorippa poussent souvent dans les mêmes points d’eau sur sol acide et ont été récoltées ensemble par des patients qui étaient alors certains de récolter du « cresson ». Par contre, sur la période allant de 1980 à 1998, N. officinale et, à un moindre degré, Nasturtium microphyllum sont seuls impliqués dans l’infestation humaine (Rondelaud et al., 2000).
Tableau I : Distribution numérique de 616 patients sur deux périodes : 1955-1980 et 1981-1998, par rapport à leur mode d’infestation. Abréviation : n, nombre de cas de fasciolose humaine sur la période.
|
Mode d’infestation |
Fréquence de consommation des plantes contaminées par les patients ( %) |
|
|
1955-1980 (n = 434) |
1981-1998 (n = 182) |
|
|
Nasturtium officinale, N. microphyllum ou hybrides |
60,5 |
98,9 |
|
Rorippa sylvestris, parfois R. amphibia |
11,2 |
0 |
|
Cresson mélangé (Nasturtium + Rorippa) |
26,0 |
0 |
|
Taraxacum officinale (pissenlit) |
1,6 |
0,5 |
|
Valerianella olitoria (mâche) |
9,2 |
0 |
|
Eau de source |
0,4 |
0 |
|
Graminée non identifiée |
0 |
0,5 |
La prédominance du cresson sur les autres espèces végétales comme plante contaminante (Tableau 1) a orienté les recherches vers les cressonnières naturelles existant sur les sols acides du Limousin. L’enquête épidémiologique réalisée auprès des patients touchés par la fasciolose a révélé l’existence de 252 cressonnières, à savoir deux plantations à usage commercial, 87 pour la consommation familiale et 146 sites dans lesquels le cresson de fontaine pousse spontanément (« cressonnières naturelles » d’après Rondelaud et al., 2000). Les deux derniers types de cressonnières sont généralement de faible superficie (< 2 m²) et se situent à l’émergence de sources permanentes ou temporaires ou encore sur le parcours de l’eau qui s’écoule de la source. La plupart d’entre elles sont localisées à l’extérieur des pâtures dans lesquelles le bétail pâture et 52 % sont clôturées par un grillage ou un mur afin d’éviter tout contact direct avec un mammifère domestique ou sauvage (Rondelaud, 1978 ; Descubes-Gouilly et al., 1986 ; Rondelaud et Mage, 1990a, b ; Rondelaud et al., 2001, 2008).
L’inventaire malacologique de 235 cressonnières à l’origine de cas humains de fasciolose a montré la présence d’une ou de deux espèces de limnées. Sur ces 235 sites, 199 n’étaient colonisés que par G. truncatula, 15 par O. glabra et quatre par Lymnaea stagnalis, Radix balthica, Stagnicola fuscus ou S. palustris. Des communautés mixtes avec deux espèces de limnées ont été observées dans les 17 autres sites dont 15 colonisés par G. truncatula et O. glabra (Rondelaud et al., 2000). Cependant, O. glabra était présent dans le filet d’eau qui s’écoulait de 121 cressonnières colonisées par G. truncatula car la Limnée étroite vit souvent sur le cours moyen d’une rigole de drainage ou d’un fossé alors que l’extrémité périphérique est colonisée par G. truncatula (Vareille-Morel et al., 1999). D’après Vareille-Morel et al. (2007), les populations de G. truncatula sont les plus nombreuses dans ces pâtures avec des effectifs moyens compris entre 50 et 100 individus par population. Celles d’O. glabra sont moins fréquentes avec des effectifs plus importants pouvant atteindre 150 individus par colonie. Dans ces conditions, les deux espèces précitées ont été soumises à des investigations parasitologiques à partir de 1990 dans 59 cressonnières naturelles (Rondelaud, 2004 ; Dreyfuss et al., 2005) comme dans 361 fermes du Limousin où des prospections ont eu lieu (Vignoles et al., 2017a, b, 2018).
2.3. La contamination des cressonnières par Fasciola hepatica
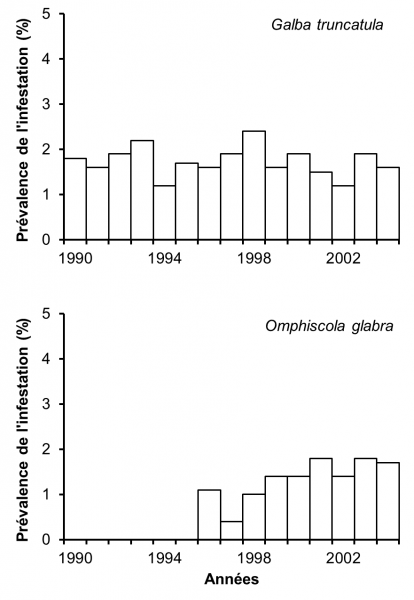
Figure 2 : Prévalence de l’infestation naturelle par Fasciola hepatica chez les limnées de 59 cressonnières naturelles du Limousin sur une période de 15 années (1990-2004). Ces chiffres proviennent de 19.249 G. truncatula et de 13.039 O. glabra récoltés au cours de cette période. D’après Rondelaud (2004) et Dreyfuss et al. (2005).
L’infestation naturelle de G. truncatula et d’O. glabra a été étudiée de 1990 à 2004 dans 59 cressonnières naturelles choisies en fonction de leur type (dans une source, dans une mare, sur le cours d’un ruisselet ou sur celui d’un fossé de drainage). Les récoltes ont eu lieu chaque année en juin ou juillet dans la cressonnière et sur le filet d’eau qui sort de celle-ci. Selon l’effectif de G. truncatula, un nombre variable de limnées adultes (4 mm et plus de hauteur) a été prélevé dans chaque population en laissant au moins 30 % des adultes sur place afin de permettre la survie de l’espèce. Comme les colonies d’O. glabra sont plus abondantes, 30 à 40 adultes (à partir de 8 mm de hauteur) jusqu’en 1993 et plus de 60 par population à partir de 1994 sont récoltés pour une dissection au laboratoire (Rondelaud, 2004). La figure 2 montre la prévalence de l’infestation naturelle par F. hepatica chez les deux limnées sur les 15 années de l’étude. Chez G. truncatula, la prévalence présente des variations allant de 2,3 à 3,7 %. L’infestation naturelle d’O. glabra par F. hepatica n’a été observée qu’à partir de 1996 et la prévalence s’est accrue par la suite jusqu’en 2001 (à 1,8 %), date au-delà de laquelle on observe un plateau dans les valeurs. Chez les deux limnées, la prévalence ne présente pas de corrélation significative avec le temps. Les seuls changements sont l’apparition d’un autre Digène, Calicophoron daubneyi, dans ces cressonnières et la possibilité pour O. glabra d’assurer le développement larvaire de F. hepatica lorsque cette limnée est co-exposée aux miracidiums des deux parasites précités (Rondelaud, 2004 ; Dreyfuss et al., 2005).
Dix plants d’Apium nodiflorum (faux-cresson) et dix de N. officinale ont, de plus été récoltés dans chaque cressonnière sur la même période. Le nombre de cressonnières contaminées par les métacercaires de F. hepatica fluctue au cours des années puisqu’il passe de 15 en 1994 à 32 en 1999. La charge en larves enkystées sur les plantes reste assez faible : de 2,6 à 6,3 en moyenne par site (Rondelaud, 2004 ; Dreyfuss et al., 2005).
2.4. Le mode d’infestation des limnées dans les cressonnières
Classiquement, G. truncatula est considéré comme l’hôte intermédiaire le plus fréquent dans l’Europe de l’Ouest (Taylor, 1965 ; Torgerson et Claxton, 1999 ; Mas-Coma et al., 2009a). Mais les juvéniles des espèces de limnées autres que G. truncatula peuvent également assurer le développement larvaire de F. hepatica lorsqu’ils sont exposés aux miracidiums dans leurs premiers jours de vie (avec une hauteur de coquille comprise entre 0,5-0,75 et 2 mm). Mais la mortalité de ces juvéniles infestés est importante, la prévalence faible et le nombre de cercaires émises généralement inférieur à 50 par individu (Kendall, 1950 ; Berghen, 1964 ; Boray, 1978 ; Busson et al., 1982 ; Vignoles et al., 2002b). Malgré le rôle des jeunes individus dans la transmission de la maladie, ce résultat ne pouvait expliquer la contamination de certains cas familiaux de distomatose lorsque le cresson contaminé provenait de cressonnières colonisées par des limnées autres que G. truncatula. Comme l’hypothèse de Limnées tronquées mortes dans ces cressonnières lors d’une émission cercarienne du parasite était difficilement vérifiable, il était logique de suggérer l’existence d’autres modes d’infestation chez ces limnées.
Tableau II : Survie au 30e jour, prévalence de l’infestation, hauteur des limnées parasitées à leur mort et nombre de cercaires émises chez les préadultes de cinq limnées co-infestées par Calicophoron daubneyi et Fasciola hepatica. D’après Dreyfuss et al. (2015a).
|
Espèce de limnée et nombre de préadultes lors de l’exposition |
Nombre de mollusques |
Hauteur de la coquille à la mort du mollusque avec émission (mm)* |
Nombre de cercaires émises (F. hepatica)* |
|
|
Survivant au 30e jour ( %) |
Emettant des cercaires (prévalence en %) |
|||
|
Galba truncatula, 600 |
443 (74,8 %) |
187 (42,2 %) |
6,7 ± 0,9 |
93,7 ± 41,2 |
|
Omphiscola glabra, 800 |
408 (51,0 %) |
84 (20,5 %) |
8,9 ± 1,5 |
31,3 ± 26,7 |
|
Radix balthica, 200 |
141 (70,5 %) |
0 (-) |
- |
0 |
|
Stagnicola fuscus, 300 |
181 (60,3 %) |
2 (1,1 %) |
11,3 ± 1,7 |
11,5 ± 3,1 |
|
S. palustris, 300 |
228 (76,0 %) |
7 (3,0 %) |
12,5 ± 2,0 |
16,5 ± 7,1 |
* Valeur moyenne ± écart type.
Tableau III : Survie au 30e jour, prévalence de l’infestation, hauteur des limnées parasitées à leur mort et nombre de cercaires émises chez les préadultes de quatre limnées infectés par Fasciola hepatica à la génération F5 (Radix balthica, Stagnicola fuscus), F6 (S. palustris) ou F7 (Omphiscola glabra). D’après Dreyfuss et al. (2015a).
|
Espèce de limnée, génération et nombre total de jeunes lors de l’exposition |
Nombre de mollusques |
Hauteur de la coquille à la mort du mollusque* |
Nombre de cercaires émises* |
|
|
Survivant au 30e jour ( %) |
Emettant des cercaires (prévalence en %) |
|||
|
Galba truncatula, F1, 200 |
142 (71,0 %) |
85 (58,8 %) |
7,5 ± 0,9 |
157,7 ± 50,4 |
|
Omphiscola glabra, F7, 200 |
103 (51,5 %) |
18 (17,4 %) |
7,6 ± 1,1 |
66,4 ± 15,5 |
|
Radix balthica, F5, 100 |
65 (65,0 %) |
13 (20,0 %) |
10,0 ± 1,1 |
66,8 ± 21,2 |
|
Stagnicola fuscus, F5, 100 |
54 (54,0 %) |
7 (12,9 %) |
11,7 ± 1,5 |
80,3 ± 35,8 |
|
S. palustris, F6, 100 |
47 (47,0 %) |
3 (6,3 %) |
12,3 ± 1,4 |
34,3 ± 11,2 |
* Valeur moyenne ± écart type.
Deux autres modes d’infestation ont été mis en évidence chez plusieurs espèces de limnées autres que G. truncatula. Le premier est la co-infestation du mollusque préadulte (4 mm de hauteur) par C. daubneyi et F. hepatica à raison de deux expositions monomiracidiennes individuelles (une par parasite) séparées par un intervalle de 4 heures à 20°C (Augot et al., 1996 ; Abrous et al., 1998). Des individus avec des formes larvaires en vie de F. hepatica, de C. daubneyi ou des deux Digènes ont ainsi été observés chez G. truncatula, O. glabra, S. fuscus et S. palustris alors que les essais ont été négatifs chez R. balthica. Cependant, le nombre de cercaires de F. hepatica est nettement plus faible chez O. glabra, S. fuscus et S. palustris que chez G. truncatula (Tableau II). Des O. glabra et S. palustris naturellement infestés par l’un, l’autre ou les deux parasites ont été retrouvés lors d’investigations sur le terrain (Abrous et al., 1999, 2000 ; Degueurce et al., 1999). Le deuxième mode est le développement graduel d’une infestation allant jusqu’à l’émission de cercaires au fur et à mesure des générations du mollusque lorsque des préadultes issus de parents déjà infestés par F. hepatica sont exposés à nouveau aux miracidiums. Trois à six générations successives selon l’espèce de la limnée ont été nécessaires pour obtenir des cercaires chez O. glabra, R. balthica, S. fuscus et S. palustris (Rondelaud et al., 2014, 2015 ; Vignoles et al., 2016a). Comme pour le deuxième mode, le nombre de cercaires émises est significativement plus faible chez ces quatre espèces de limnées que chez G. truncatula lorsque le même protocole expérimental est utilisé pour ces cinq espèces (Tableau III). Ces deux modes démontrent que le parasite est capable de s’adapter à son hôte intermédiaire et qu’il existe probablement d’autres modes que F. hepatica utilise pour assurer le développement de ses formes larvaires chez un mollusque hôte inhabituel.
3. Le développement larvaire de Fasciola hepatica chez le mollusque hôte
La mise en place d’un contrôle de la fasciolose dans une région donnée impose de connaître l’écologie du mollusque hôte et le développement larvaire du parasite chez ce dernier. Comme des inconnues existaient encore dans le déroulement du cycle chez la limnée, plusieurs études ont été réalisées sur la dynamique de deux stades larvaires et la réponse viscérale du mollusque vis-à-vis du parasitisme.
3.1. Les générations rédiennes du parasite
Classiquement, deux générations successives de F. hepatica se développent dans le corps de la limnée. Lorsque le sporocyste résultant de la transformation du miracidium s’est complètement différencié, il produit des rédies de première génération. Celles-ci deviennent indépendantes dans le corps du mollusque et produisent à leur tour des rédies filles (formant la deuxième génération) ou des cercaires selon les conditions environnementales. Les facteurs responsables de cette orientation vers la formation de rédies filles ou de cercaires varient selon les auteurs (Thomas, 1883a, b ; Kendall, 1965 ; Styczynska-Jurewicz, 1965 ; Wilson et Draskau, 1978). Malgré cette contradiction plus qu’apparente, le concept de deux générations rédienne est encore largement enseigné (Rondelaud et al., 2009a). Comme ces générations rédiennes n’avaient jamais été étudiées sur le plan histologique, des coupes sériées de G. truncatula infestées par F. hepatica et sacrifiées à des intervalles réguliers ont été étudiées pour suivre le développement de ces rédies dans le temps car ces générations peuvent être identifiées d’après la forme et les dimensions de leurs pharynx (Augot et al., 1998, 1999).
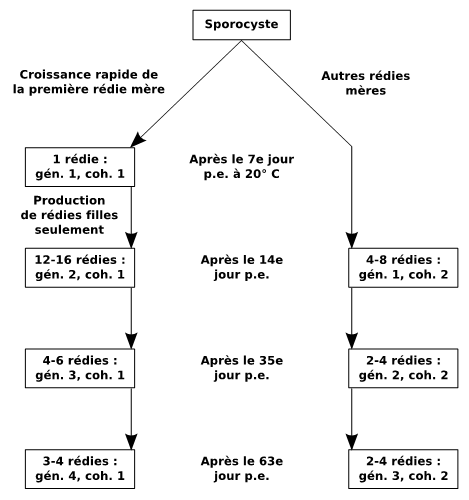
Figure 3 : Développement normal des générations rédiennes de Fasciola hepatica chez Galba truncatula soumis à des expositions monomiracidiennes individuelles, avec indication du nombre de rédies pour chaque cohorte. Abréviations : coh., cohorte ; gén., génération ; p.e., post-exposition. D’après Rondelaud et al. (2009a, b).
Trois et parfois quatre générations rédiennes (Fig. 3) se succèdent chez G. truncatula. L’action décisive est assurée par la première rédie de première génération (la rédie qui sort en premier du sporocyste). Si cette larve survit au cours de l’infestation, au moins jusqu’au 49ème jour post-exposition, le développement des générations est normal (Rondelaud, 1978 ; Rondelaud et Barthe, 1862a). La première rédie de première génération ne produit que des rédies filles appartenant à la première cohorte de seconde génération. En conséquence, la production rédienne moyenne chez des limnées vivant sur sol acide varie de 28 à 43 larves au 88ème jour post-exposition (à cette date, la hauteur des limnées adultes souvent ne dépasse pas 8 mm). Pour des tailles plus élevées (jusqu’à 12 mm), la charge peut atteindre jusqu’à 56 rédies en moyenne, avec un accroissement numérique chez les rédies de troisième et de quatrième générations (Rondelaud et Barthe, 1987). Si la première rédie de première génération meurt, le développement est anormal et la production en rédies filles est assurée par la deuxième rédie de première génération ou par la première rédie de deuxième génération (Rondelaud et Barthe, 1982b). Cependant, le nombre de rédies filles produites par cette rédie de substitution est plus faible (de deux à six) et ce processus se produit tardivement (les premières rédies filles ne deviennent indépendantes qu’après le 30ème jour post-exposition à 20° C). D’après Rondelaud et Barthe (1982b), la première variante du développement anormal a été observée chez 20 % environ des mollusques infestés tandis que la deuxième variante est rare (< 0,1 %).
L’action de différents facteurs environnementaux ou biotiques sur le développement de ces générations a aussi été étudiée. Les générations ont été retrouvées dans tous les cas mais avec des variations dans le nombre des rédies indépendantes et en vie. Selon la nature du facteur, cette limitation touche toutes les générations ou bien n’affecte que les rédies filles produites à partir du 35e jour post-exposition ou du 63e jour (Rondelaud et al., 2009a ; Dreyfuss et al., 2016).
3.2. Les émissions cercariennes du parasite
Toutes les populations de G. truncatula (le mollusque hôte le plus commun dans la région du Limousin) ne sont pas capables d’assurer le développement larvaire complet du parasite. Dans une étude expérimentale que Rondelaud (1993) a réalisée sur 17 populations différant entre elles par le type de contact avec le bétail parasité, cet auteur a montré que le nombre de limnées infestées, qui meurent sans émission, augmente lorsque le contact avec le parasite devient de plus en plus rare. Dans le même sens, les métacercaires fixées sur un support sont de moins en moins nombreuses tandis que les kystes flottants augmentent en nombre. Plusieurs colonies vivant sur des berges de rivières, où le contact avec le parasite est rare ou nul, n’ont présenté que des infestations abortives lorsqu’elles avaient été exposées à plusieurs reprises aux miracidiums de F. hepatica sans que l’on puisse parler d’une véritable résistance de ces mollusques à ce type de parasitisme (Rondelaud et al., 2009a). En plus de cette variabilité interpopulationnelle, il existe aussi une variabilité à l’intérieur d’une même colonie car tous les individus infestés qui la constituent n’effectuent pas des émissions cercariennes. Lorsque la prévalence de l’infestation dans les populations de G. truncatula diminue, le nombre de limnées qui effectuent des émissions cercariennes décroît également tandis que les limnées mourant sans émission et celles qui ne contiennent que des sporocystes ou des rédies de F. hepatica augmentent en nombre (Vignoles et al., 2002a). Ce dernier résultat n’a pas encore reçu d’explication satisfaisante car les mollusques sont infestés et élevés dans les mêmes conditions expérimentales. L’hypothèse proposée à l’heure actuelle est de rapporter cette variabilité intrapopulationnelle à la sensibilité propre de chaque individu par rapport au parasite (Dreyfuss et al., 2016).
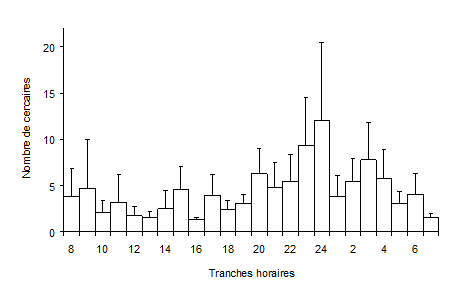
Figure 4 : Nombre de cercaires émises par 57 Galba truncatula infestés par Fasciola hepatica par rapport aux différentes heures du jour. Les moyennes sont indiquées avec leurs écarts types. D’après Audousset et al. (1989).
Les cercaires de F. hepatica sont émises par le mollusque sous forme de vagues d’un à plusieurs jours, séparées par des repos. Un rythme circadien dans les émissions (Fig. 4), avec une production maximale au cours de la nuit a été décrit chez G. truncatula (Audousset et al., 1989). Lorsque les limnées sont élevées dans des conditions semi-naturelles, Audousset et al. (1989) rapportent également l’existence d’un rythme infradien (périodicité supérieure à 24 heures) mais ce rythme n’a pas été retrouvé dans les conditions constantes du laboratoire (Dreyfuss et Rondelaud, 1994). D’après Vignoles et al. (2006), ce rythme infradien ne s’observe que chez certains individus infestés dans une population lorsque ces derniers libèrent leurs cercaires à intervalles réguliers (tous les 6 à 8 jours) au cours de la période patente. L’influence de plusieurs facteurs tels que la température ont déjà été précisés par de nombreux auteurs (Kendall et McCullough, 1951 ; Hodasi, 1972, par exemple). Titi et al. (2016) et Vignoles et al. (2016) ont, en plus, montré que l’intensité de la lumière naturelle, couplée à la nébulosité, avaient, elles aussi, une influence sur la dynamique de ces émissions cercariennes.
Parmi les métacercaires de F. hepatica, les kystes flottants étaient déjà connus depuis les années 1880 (Thomas, 1883a, b). Par contre, leur structure, leur dynamique au cours des émissions et leur pouvoir infestant n’avaient pas été encore étudiés jusqu’aux années 1990 (Morley, 2015). Ces métacercaires présentent une collerette formée par des fibrilles dissociées provenant de la paroi du kyste. Cette collerette contient des lacunes aérifères, ce qui permet au kyste de flotter eu eau stagnante sur une longue période (Esclaire et al., 1989). Par contre, la survenue d’une eau courante les fait tomber rapidement sur le fond (Vareille-Morel et al., 1993). Ces kystes sont produits en nombre (jusqu’à 30 % des métacercaires formées) au début des deux premières vagues d’émission alors qu’ils sont nettement plus rares lors des vagues suivantes (Vareille-Morel et al., 1994). Des variations quotidiennes de température allant de 12° à 25° C ont permis d’obtenir deux fois plus de kystes flottants qu’avec une température constante de 20° C, alors que les autres facteurs testés n’ont pas eu d’effet significatif sur leur production (Vareille-Morel et Rondelaud, 1991). L’infestation d’un hôte définitif par ce type de kystes a abouti aux mêmes résultats positifs qu’avec des métacercaires fixées (Rondelaud et al., 2009a).
3.3. Parasitisme et pathologie viscérale chez la limnée
Après la pénétration du miracidium chez le mollusque, le sporocyste effectue des migrations dans le corps de ce dernier pendant la première semaine post-infestation pour se fixer dans un site préférentiel (généralement la région réno-péricardique). Ces migrations laissent des traces sous forme de lacunes en forme de tunnel aussi bien dans le pied et les tentacules de la limnée que dans le manteau et les organes internes (Préveraud-Sindou et Rondelaud, 1992). Ces lacunes permettent de déterminer si le mollusque a été infesté ou non par un ou plusieurs miracidium(s). Cette pathologie a été retrouvée chez toutes les espèces françaises de Lymnaeidae lorsqu’elles sont exposées aux miracidiums de F. hepatica (Préveraud-Sindou et al., 1994).
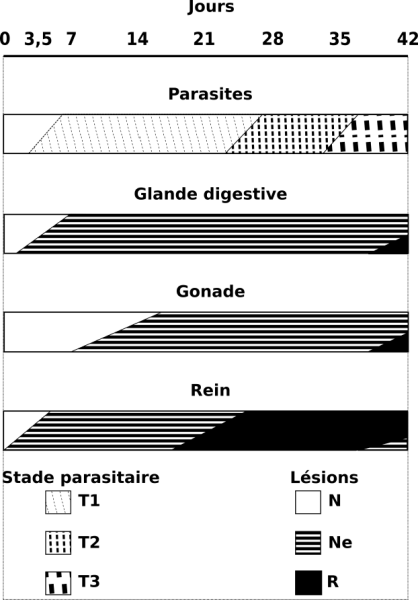
Figure 5 : Réponse de trois viscères chez Galba truncatula infesté par Fasciola hepatica. La chronologie des lésions tissulaires et les divers stades du développement larvaire du parasite sont indiqués jusqu’au 42ème jour d’infestation à 20°C. Stades parasitaires : T1, rédies immatures ; T2, rédies contenant des cercaires ; T3, cercaires indépendantes dans le corps du mollusque. Lésions tissulaires : N, aspect normal de l’organe ; Ne, nécrose épithéliale ; R, reconstitution épithéliale. D’après Rondelaud et al. (2003, 2009a).
Au cours des semaines qui suivent, plusieurs organes internes, à savoir la glande digestive, la gonade, la glande de l’albumine et le rein présentent une pathologie particulière sous la forme d’une nécrose épithéliale d’abord multifocale, puis généralisée, suivie d’une reconstitution de cet épithélium avec hyperplasie cellulaire (Rondelaud et al., 2009a). La figure 5 montre l’évolution de cette pathologie au cours de l’infestation chez trois viscères par rapport au développement des générations rédiennes du parasite. La nécrose épithéliale apparaît rapidement dans le rein du mollusque, alors qu’elle débute plus tardivement dans les deux autres glandes. Si l’on fait exception du rein où la reconstitution de l’épithélium se produit à partir du 21ème jour d’infestation, la nécrose se développe dans les deux autres viscères lors de la période où les cercaires se différencient dans le corps des rédies parentales. La reconstitution épithéliale commence seulement au 42ème jour post-exposition alors que les premières cercaires deviennent indépendantes dans le corps du mollusque. Dans le cas du rein, cette dernière date correspond au développement d’une autre vague de nécrose épithéliale (Sindou, 2017).
Si la limnée est soumise à deux expositions successives avec des miracidiums du même Digène ou d’espèces différentes, on assiste à un chevauchement d’une nouvelle vague de nécrose sur un épithélium en reconstitution et ce processus est d’autant plus important que l’intervalle de temps séparant les deux expositions est long (Rondelaud et al., 2009a ; Dreyfuss et al., 2016).
4. Le contrôle des populations de limnées.
L’épizootie de fasciolose animale survenue en 1969 a incité les éleveurs à demander qu’un contrôle des populations du mollusque hôte (G. truncatula) soit mis au point. Quelques essais locaux ont été alors pratiqués avec le Frescon® en 1969 et 1970, mais ils se sont révélés inappropriés en modifiant la végétation des sites traités, même si les effets sur les mollusques se sont révélés concluants (données non publiées). C’est la raison pour laquelle un contrôle biologique de G. truncatula a été développé à partir de 1975 mais il était nécessaire dans un premier temps de définir les types d’habitats que la limnée colonise sur les sols acides du nord de la Haute-Vienne et de déterminer leurs caractéristiques.
4.1. Les habitats des limnées sur sol acide
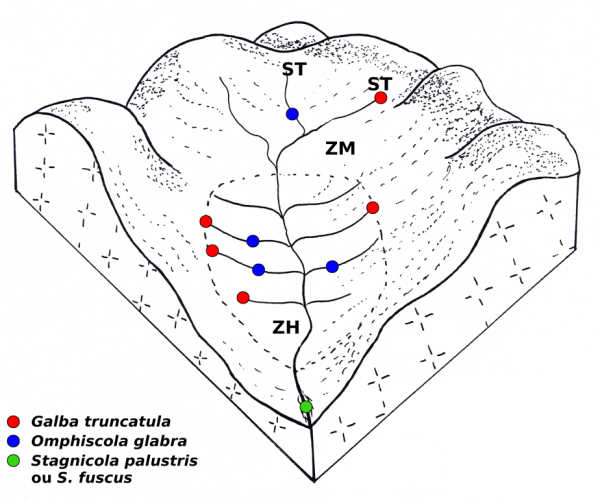
Figure 6 : Bloc-diagramme montrant la localisation des habitats colonisés par plusieurs espèces de limnées sur le réseau de drainage superficiel dans une prairie marécageuse sur sol acide. Abréviations : ZH, zone hygrophile ; ZM, zone mésophile ; ST, source temporaire.
Dans une prairie marécageuse sur sol acide, plusieurs espèces de limnées peuvent être reconnues. La figure 6 montre cette systématisation des habitats pour quatre d’entre elles. Galba truncatula colonise préférentiellement l’extrémité périphérique des rigoles de drainage superficiel, qu’il y ait ou non une source temporaire ou permanente, alors qu’O. glabra vit sur le cours moyen de ces mêmes rigoles. L’une ou l’autre des deux espèces de Stagnicola s’observe parfois dans la partie inférieure du fossé de drainage et Radix balthica dans le ruisseau sur lequel s’ouvre ce fossé (Vareille-Morel et al., 1999). Malgré la présence de ces quatre espèces dans une prairie, leurs populations sont nettement séparées les unes des autres et les communautés mixtes formées par deux ou trois espèces sont relativement rares (Vareille et al., 1996 ; Vareille-Morel et al., 2007).
Les habitats de G. truncatula sont les plus nombreux dans le Limousin (7.709 populations sur un total de 11.992 points d’eau inventoriées dans 361 fermes élevant du bétail) et peuvent être identifiés à l’aide de plantes indicatrices comme Juncus acutiflorus. Ils sont généralement de faible superficie (moins de 2 m² pour 56,8 % d’entre eux) avec un effectif ne dépassant 25 adultes transhivernants par mètre carré dans 54,4 % des cas (Rondelaud et al., 2011). Dans le cas d’O. glabra, le nombre de populations est nettement plus faible (3137 sur un total de 11.992 points d’eau prospectés dans les mêmes fermes) et peuvent aussi être reconnus par la présence de Juncus effusus. La superficie des habitats est plus importante ((jusqu’à 10 m² pour 84,7 % d’entre eux) tandis que l’effectif au mètre carré est nettement plus faible avec 10 adultes transhivernants ou moins dans 68,4 % des cas (Vignoles et al., 2017c). Chez les deux espèces, le nombre d’habitats diminue fortement lorsque l’altitude augmente et ce fait doit être rapporté à une acidité plus importante au-dessus de 400 ou de 500 m selon l’espèce de la limnée (Dreyfuss et al., 2018b, c). Le nombre d’habitats colonisés par l’une ou l’autre des espèces de Stagnicola est faible (67 habitats pour S. fuscus et 72 pour S. palustris sur les fermes précitées). La première espèce préfère les fossés de drainage ou de route alors que la seconde vit essentiellement dans les étangs (Vareille-Morel et al., 2007).
Sur sols acides, l’entretien régulier du système de drainage superficiel dans les prairies permet le maintien des populations de G. truncatula ou d’O. glabra, alors que l’absence d’entretien aboutit graduellement à la disparition des populations, tout au moins pour G. truncatula (Rondelaud, 1977 ; Moens, 1981). Dans les prairies, les limnées ne sont pas les seules car d’autres mollusques colonisent ces stations. Parmi celles-ci, figure un mollusque hygrophile, Zonitoides nitidus. Comme ce dernier effectue une prédation sur les limnées au début de l’assèchement estival (Rondelaud, 1975), il est à la base d’un contrôle biologique qui a été développé contre G. truncatula.
4.2. Le contrôle de Galba truncatula sur sols acides
Trois techniques ont été utilisées. La première est basée sur une fauche de la végétation hygrophile au début de l’assèchement estival et son dépôt sur l’habitat de G. truncatula, ce qui permet le maintien de l’humidité et attire les prédateurs locaux. Si nécessaire, des Z. nitidus sont introduits à raison de 20 par m² d’habitat. La deuxième technique ne comporte pas de fauche du milieu naturel mais un nombre plus élevé de prédateurs sont introduits (60/m²). Enfin la troisième technique s’effectue en deux temps, avec un déversement d’une solution de chlorure cuivrique (8 L à 0,1 mg/L) dans chaque gîte en avril lors de l’appariement printanier des limnées et l’introduction ou non de 20 Z. nitidus/m² au début de l’assèchement estival (Ximenes, 1991). Ces trois techniques ont été appliquées dans 122 prairies de fond de vallée, 59 jonchaies de pente, 11 zones piétinées, 37 berges de rivière ou d’étang et 134 cressonnières sauvages (Rondelaud et al., 2006b).
Tableau IV : Pourcentage de Galba truncatula en vie, décomptés en septembre dans plusieurs types d’habitats sur sols acides après un contrôle de 1, 2, 3 et 4 années avec Zonitoides nitidus. D’après Rondelaud et al. (2006).
|
Type d’habitat |
Nombre |
Pourcentage de Galba truncatula en vie, décompté en Septembre après un contrôle de |
|||
|
1 an |
2 ans |
3 ans |
4 ans |
||
|
Prairies marécageuses |
|||||
|
Témoins |
9 |
94,3 |
90,2 |
92,7 |
96,5 |
|
Traitées avec fauche |
78 |
11,5 |
0,1 |
0 |
0 |
|
Traitées sans fauche |
14 |
91,2 |
87,3 |
95,3 |
88,7 |
|
Jonchaies avec source temporaire |
|||||
|
Témoins |
3 |
78,5 |
69,6 |
81,3 |
73,6 |
|
Traitées avec fauche |
20 |
5,1 |
0,6 |
0 |
0 |
|
Traitées sans fauche |
4 |
81,7 |
63,2 |
56,5 |
43,7 |
|
Jonchaies avec source permanente |
|||||
|
Traitées avec fauche |
1 |
29,1 |
22,5 |
17,5 |
9,3 |
|
Traitées sans fauche |
2 |
61,3 |
47,6 |
32,1 |
15,4 |
|
Cressonnières naturelles |
|||||
|
Traitées avec fauche |
15 |
39,6 |
7,2 |
2,3 |
0 |
Le tableau IV donne les pourcentages de survie pour G. truncatula en septembre dans plusieurs types d’habitats après un contrôle de 1, 2, 3 et 4 année(s) avec Z. nitidus. La fauche de la végétation hygrophile en juin et son dépôt sur les habitats du mollusque ont permis d’éliminer G. truncatula après deux années de contrôle dans les habitats situés dans les prairies marécageuses et autour des sources intermittentes. Dans le cas des cressonnières sauvages, trois années ont été nécessaires. Par contre, autour des sources permanentes, il n'y a eu qu'une diminution progressive dans le nombre des G. truncatula au cours des quatre années de contrôle. Dans les habitats traités sans fauche, les populations de G. truncatula sont restées stables tout comme les témoins (prairies marécageuses) ou ont légèrement diminué au cours du temps (les deux types de jonchaies). L’emploi d’une association de mollusques prédateurs : Z. nitidus + Oxychilus draparnaudi, a permis l’élimination des G. truncatula en une seule année (jonchaies avec source intermittente) ou en deux années (prairies marécageuses, cressonnières naturelles). Enfin, dans les 117 cressonnières traitées par le chlorure cuivrique et Z. nitidus, aucune limnée n’a été décomptée en septembre après une seule année de contrôle, alors que dans les 17 autres, deux années ont été nécessaires pour éliminer la Limnée tronquée (Rondelaud et al., 2006b).
Si l’on fait exception de quelques propriétaires qui ont introduit chaque année des Z. nitidus dans leur cressonnière, l'emploi de ce mollusque pour contrôler G. truncatula ne s’est pas généralisé dans les élevages de bovins et de moutons situés dans le département de la Haute-Vienne. Les raisons de cette situation sont probablement la complexité des techniques pour l'application de ce contrôle sur le terrain par des non-spécialistes et la difficulté de sélectionner la date de ce contrôle à la fin du mois de juin en raison des pluies qui sont fréquentes à cette période (Rondelaud et al., 2006b).
4.3. La lutte intégrée contre la fasciolose
Le but du concept est de mettre en œuvre les différents moyens prophylactiques que l’on possède pour éradiquer la fasciolose sur certaines exploitations et limiter la fréquence de la maladie dans la plupart des autres fermes (Mage et Rondelaud, 1983). La première étape est de déterminer la présence du parasite chez le bétail par coproscopies ou par sérologie. Parallèlement à cette action, il faut étudier la topographie du terrain, la portance du sol, les écoulements de l’eau de ruissellement, et analyser la gestion des pâturages. Les habitats du mollusque sont isolés dans une deuxième étape à l’aide de clôtures et on pratique un déparasitage de l’hôte définitif à l’aide d’un anthelminthique. La troisième étape porte sur le choix de la technique pour éliminer les populations de limnées. L’isolement des gîtes doit être pratiqué en l’absence de toute autre possibilité. Les zones très marécageuses sont à transformer en étangs. Le drainage superficiel doit être effectué lorsque les zones à traiter sont de grande superficie. Les gîtes de petite taille comme les jonchaies sont à traiter à l’aide d’un molluscicide ou de mollusques prédateurs).
Le premier essai s’est déroulé dans un élevage de bovins allaitants de la Corrèze. En 1986, le troupeau était composé de 30 bovins et les coproscopies étaient toutes positives. Les G. truncatula n’ont été retrouvées que dans une seule zone où les bovins stationnaient avant d’entrer en stabulation. Les différentes mesures du concept ont été appliquées sur le troupeau et le parc d’attente. Les limnées ont disparu à la fin 1988 et les coproscopies réalisées après l’assainissement du parc d’attente ont toutes été négatives (Mage et al., 1989). D’autres essais ont été réalisés dans les prairies d’estive. Trois élevages laitiers du Cantal ont appliqué simultanément un fasciolicide chez 164 bovins et supprimé les sources d’infestation présentes sur ces exploitations. A la fin de la deuxième année, le pourcentage de bovins naturellement parasités par F. hepatica n’était plus que de 11,1 % lors de la mise à l’herbe alors qu’il était de 57,4 % dans les 10 élevages qui n’ont utilisé que le seul fasciolicide comme prévention thérapeutique (Mage et al., 1995).
5. Discussion
En raison des trois thèmes de recherche explorés par notre équipe au cours des 48 dernières années, le commentaire des résultats présentés ci-dessus sera réalisé pour chaque axe considéré séparément.
5.1. La fasciolose humaine et son devenir
La forte diminution, que l’on observe à l’heure actuelle dans les cas de distomatose humaine, existe également au niveau du bétail local depuis que le triclabendazole est utilisé par les éleveurs comme traitement anthelminthique contre la maladie (Reynal, 2001). L’emploi de ce médicament s’est accompagné d’une augmentation sensible dans le nombre de bovins touchés par la paramphistomose à C. daubneyi (Mage et al., 2002) alors que les moutons ne semblent pas être affectés par cette parasitose (D. Rondelaud, observation personnelle). Comme des cas de résistance au triclabendazole sont rapportés de plus en plus chez le bétail (Moll et al., 2000 ; Olaechea et al., 2011 ; Kelley et al., 2016), on peut se demander comment la prévalence de la maladie évoluera dans les années à venir d’autant plus que d’autres hôtes définitifs de ce parasite comme les ragondins (Ménard et al., 2001) et les lagomorphes (Rondelaud et al., 2001) sont, eux aussi, porteurs du parasite et peuvent assurer la continuité du cycle parasitaire car ils ne sont pas traités. Malgré ce risque possible, les cas de distomatose humaine dans le Limousin sont devenus rares en raison d’un changement dans les habitudes alimentaires chez les jeunes. A l’inverse de leurs ainés, les jeunes générations délaissent de plus en plus le cresson de fontaine comme aliment et les quelques gourmets qui existent encore ne récoltent plus le cresson sauvage dans le milieu naturel, tout au moins dans la région (Rondelaud et al., 2000).
Depuis la loi du 5 janvier 2006 et l’ordonnance du 5 octobre 2006, la commercialisation du cresson de fontaine en France relève de la responsabilité des seuls vendeurs, ce qui revient, entre autres, à autoriser la vente de produits de cueillette comme c’est le cas pour les champignons (Houin, 2009). Comme la plupart des plantations de culture familiale et des cressonnières « sauvages » dans le Limousin ne sont pas contrôlées sur le plan sanitaire, on peut s’attendre, dans l’avenir, à la réapparition des vendeurs de cresson sur les marchés locaux, comme c’était le cas avant les années 1970, et à la vente de produits récoltés dans le milieu naturel. La survenue de quelques cas chez l’homme n’est donc pas à exclure dans la région. Il serait utile que cette parasitose chez l’homme fasse partie des maladies à déclaration obligatoire, en particulier pour le Limousin où les demandes de diagnostic pour la fasciolose humaine sont encore envoyés vers des laboratoires spécialisés situés à plus de 100 km et plus de la région.
L’inventaire malacologique des cressonnières « sauvages » a montré la présence de plusieurs espèces de limnées, même si G. truncatula est l’espèce dominante. L’infestation expérimentale de ces populations par F. hepatica a, de plus, révélé l’existence de trois modes d’infestation possibles chez ces mollusques. Ces résultats démontrent que le parasite est capable de s’adapter à son hôte intermédiaire, quel qu’il soit, et n’excluent pas qu’il existe encore d’autres modes d’infestation des mollusques qui ne sont pas encore connus. Cette affirmation est basée sur les observations de Dreyfuss et al. (2000). D’après ces auteurs, des juvéniles et des préadultes avec des rédies et des cercaires de F. hepatica ont été obtenus après l’infestation expérimentale d’une population de Radix balthica, vivant dans un milieu soumis à des pulvérisations régulières d’un herbicide pour détruire la végétation aquatique. Le mécanisme selon lequel ce type de population peut s’infecter par F. hepatica est encore à explorer.
5.2. Le cycle de Fasciola hepatica chez le mollusque hôte
La mise en évidence de trois, voire de quatre générations rédiennes dans le cycle du parasite contraste avec le schéma à deux générations que Leuckart (1881, 1882) et Thomas (1883a, b) avaient rapporté dans leurs travaux. En fait, cette différence n’est qu’apparente car la première génération proposée par ces auteurs est constituée par des rédies de la première génération (cohorte 2) et des rédies filles appartenant à la deuxième génération (cohorte 1). Ces deux groupes de rédies (voir la figure 3) se développent chez le mollusque dans le même laps de temps si bien que les auteurs précités les ont considérés comme faisant partie de la même génération. Dans le même sens, la deuxième génération rapportée par ces auteurs correspond à des rédies de deuxième génération (cohorte 2) et à d’autres appartenant à la troisième génération. Ces deux autres groupes de rédies se développent ensemble pour devenir indépendantes dans le corps du mollusque après le 35ème jour d’infestation à la température constante de 20° C (Fig. 3). L’histologie réalisée sur des limnées infectées a donc permis d’apporter plus de précision que les simples observations morphologiques sur le développement de ces générations rédiennes.
A l’inverse des générations rédiennes, la variabilité qui existe dans l’infestation de la Limnée tronquée par F. hepatica selon l’origine des populations ou les individus qui constituent chaque colonie appelle davantage de commentaires. L’explication proposée par Rondelaud (1993) pour expliquer la variabilité interpopulationnelle est de rapporter cette dernière à la fréquence des contacts entre le mollusque et son parasite dans le milieu naturel. Lorsque les contacts sont rares, la prévalence de la maladie reste faible chez G. truncatula. Cette explication a été confortée depuis par les résultats positifs que Rondelaud et al. (2014, 2015), Vignoles et al. (2014) ont rapportés chez d’autres espèces de limnées en soumettant des juvéniles et des préadultes, issus de parents déjà infectés par F. hepatica, aux miracidiums du parasite et ce sur plusieurs générations successives de la limnée. D’après ces auteurs, le développement larvaire du parasite s’effectue progressivement au fur et à mesure des générations pour aboutir à des émissions cercariennes. La variabilité intrapopulationnelle observée chez les individus d’une même population de limnées par rapport à F. hepatica n’a toujours pas été expliquée par une hypothèse solide, surtout lorsque ces mollusques proviennent d’un nombre réduit de parents comme c’est le cas dans la plupart des populations de G. truncatula vivant sur sol acide (Rondelaud et al., 2009a). Deux hypothèses peut-être complémentaires peuvent être formulées pour expliquer cette variabilité. La première est de rapporter ces différences à des modifications d’ordre biochimique qui s’opèrent dans le corps des mollusques parasités (les rédies et les cercaires en se développant « pompent » le glycogène et les acides gras présents dans le corps de la limnée d’après Graczyk et Fried en 1999) et ces changements seraient transmis à leurs descendants, permettant ainsi d’améliorer la sensibilité de ces individus au parasitisme. La seconde hypothèse est basée sur la génétique et fait appel à des séquences d’ADN mobiles du parasite qui seraient insérées de plus en plus dans l’ADN du mollusque au fur et à mesure des infestations naturelles ou expérimentales, ce qui aurait pour conséquence d’accroître la sensibilité de la limnée à son parasite.
Une pathologie viscérale sous forme d’une nécrose épithéliale, suivie d’une reconstitution, a été mise en évidence au niveau de quatre viscères chez plusieurs espèces de Lymnaeidae et de Physidae lorsqu’elles sont soumises aux miracidiums de F. hepatica (Barthe et Rondelaud, 1986 ; Sindou et al., 1990). Ces lésions ont, de même, été retrouvées chez deux Planorbidae, à savoir Bulinus truncatus et Planorbarius metidjensis, lorsqu’ils sont exposés aux miracidiums de Schistosoma haematobium (Zekhnini, 1994). Ces résultats montrent que cette pathologie viscérale n’est pas spécifique d’un parasite donné et qu’elle peut se développer dans les différentes familles de Pulmonés dulçaquicoles, quelle que soit l’espèce. Devant ces résultats, on peut émettre l’hypothèse que le cycle nécrose épithéliale-reconstitution serait un processus généralisé qui toucherait tous les mollusques aquatiques lorsqu’ils sont soumis pendant plusieurs jours au moins à une agression externe. Un argument supportant cette approche provient des observations de Rondelaud et Dreyfuss (1996) sur O. glabra. D’après ces auteurs, les trois viscères étudiés chez cette limnée ont présenté une nécrose épithéliale, suivie d’une reconstitution, lorsqu’ils ont été soumis à une dose sublétale de molluscicide pendant quatre jours avant d’être remis dans une eau non polluée pendant les 21 jours suivants.
5.3. Les habitats des limnées et leur contrôle
Plusieurs publications ont traité des effets du réchauffement climatique sur le devenir des parasitoses humaines et animales, notamment de la fasciolose (Mas-Coma et al., 2009b ; Fox et al., 2011 ; Mehmood et al., 2017, par exemple). A l’inverse, l’évolution du mollusque hôte est nettement moins considérée. Le cas de G. truncatula ne paraît pas préoccupant dans l’immédiat. Même si le nombre des populations chez cette espèce a diminué au cours des 50 dernières années (Dreyfuss et al., 2016, 2018a), l’espèce est connu pour être un mollusque invasif (Seddon et al., 2015) et est capable de s’adapter à un nouvel environnement. En effet, plus de 74 % des G. truncatula, y compris les adultes, s’enterrent complètement dans le sol lors d’assèchements périodiques allant de 11 à 18 jours dans la zone irriguée des Doukkala (Maroc), ce qui permet la survie de l’espèce dans un climat semi-aride (Belfaiza et al., 2009). Par contre, ce processus est rare sous climat tempéré et ne touche que les juvéniles (Rondelaud et Morel-Vareille, 1975). A l’inverse de la Limnée tronquée, le devenir des populations d’O. glabra est nettement plus critique. Comme cette limnée n’a qu’une répartition géographique limitée depuis le sud de la Scandinavie jusqu’au nord de l’Espagne et ne dépasse pas 415 m d’altitude dans le Limousin (Dreyfuss et al., 2018c), on peut se demander si cette limnée survivra au réchauffement climatique dans l’avenir.
Par rapport aux années 1970 où les éleveurs réclamaient que les populations du mollusque hôte, en l’occurrence G. truncatula, soient contrôlées afin que cette espèce soit éliminée dans leurs prairies sur sol acide, la situation a bien changé à l’heure actuelle en raison de l’intérêt croissant des jeunes générations pour la biodiversité et le respect de la faune. Malgré son intérêt, le contrôle biologique à l’aide de mollusques prédateurs n’a eu qu’un intérêt limité auprès des éleveurs ou des propriétaires de cressonnières naturelles en raison des difficultés de mise en œuvre (Rondelaud et al., 2009a). Il en est de même pour le contrôle intégré de la fasciolose car beaucoup de fermiers préfèrent traiter leurs bovins et parfois leurs ovins avec le triclabendazole et ne veulent pas entreprendre les travaux qui seraient nécessaires pour assainir leurs prairies et prévenir le risque du parasitisme (D. Rondelaud, observation personnelle). Malgré cette limite, la préservation des populations de limnées lors d’un contrôle intégré est possible en isolant leurs habitats du reste des pâtures (la superficie de ces habitats sur sol acide est généralement faible) comme l’a montré une expérience réalisée de 2011 à 2014 dans deux fermes de la Haute-Vienne (Vignoles et al., 2016b).
6. Conclusion
Par rapport aux trois thèmes de recherche définis dans les années 1970, l’étude épidémiologique de la fasciolose humaine dans le Limousin et les investigations pour comprendre le mode d’infestation ont été menées à terme, même si des études sont encore nécessaires pour élucider certains modes particuliers d’infestation du mollusque par le parasite (cas des limnées provenant d’habitats pollués, par exemple). La plupart des recherches fondamentales sur le développement larvaire du parasite chez le mollusque hôte ont été réalisées. Seuls plusieurs points dans la distribution des métacercaires de F. hepatica sur les plantes hôtes dans le milieu naturel sont encore à élucider. A l’inverse des deux axes précédents, le dernier thème n’a été que partiellement exploré. A l’heure actuelle, le contrôle des limnées dans une région donnée n’est plus d’actualité, tout au moins dans les pays tempérés de l’Europe de l’ouest. D’autres investigations seraient encore nécessaires pour comprendre le mécanisme selon lequel le parasite réussit à développer ses formes larvaires jusqu’à l’émission ou non des cercaires chez le mollusque hôte, ou bien dégénère dans les jours qui suivent l’entrée du miracidium chez ce dernier.