Les diagrammes d'énergie du naphtalène et du 1-méthoxy-naphtalène sont représentés sur la figure suivante :
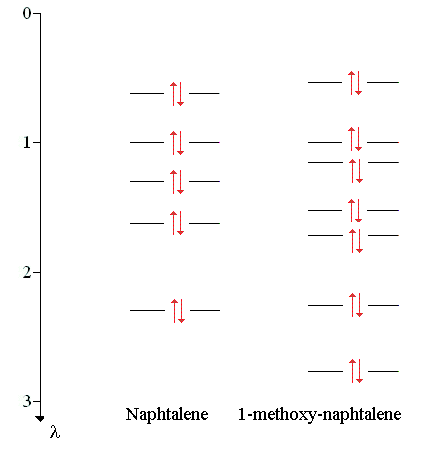 |
L'énergie des électrons π du naphtalène est donc :
2 (αC + 2,30 βCC) +
2 (αC + 1,62 βCC) +
2 (αC + 1,30 βCC) +
2 (αC + 1,00 βCC) +
2 (αC + 0,62 βCC)
= 10 αC + 13,68 βCC
L'oxygène est hybridé sp2 (type énol). Il fournit deux électrons au système π
L'énergie des électrons π du 1-méthoxy-naphtalène est :
2 (αC + 2,77 βCC) +
2 (αC + 2,26 βCC) +
2 (αC + 1,72 βCC) +
2 (αC + 1,52 βCC) +
2 (αC + 1,15 βCC) +
2 (αC + 1,00 βCC) +
2 (αC + 0,53 βCC)
= 14 αC + 21,9 βCC
Le 1-méthoxy-naphtalène est le meilleur nucléophile car il a la plus grande énergie pour l'orbitale HOMO.
Il faut considérer l'orbitale HOMO. Le site privilégié de l'attaque électrophile correspond à l'atome ayant le plus fort coefficient (en valeur absolue) pour cette orbitale. Il s'agit donc du carbone en position para par rapport au substituant méthoxy.
Le carbone sp2 fournissant un électron au système π la charge nette de cet atome est donnée par :
q = 1 - 2 (0,072 + 0,292 + 0,022 + 0,432 + 0,192 + 0,462) = -0,04
La charge très légèrement négative facilite l'attaque électrophile car le réactif électrophile est chargé positivement.