Caractéristiques des pontes et croissance d'Omphiscola glabra chez quatre populations vivant sur marne ou sur granite Characteristics of egg-masses and shell growth of Omphiscola glabra in four snail populations living on marl or granite
Des investigations de terrain ont été effectuées pendant 12 mois dans quatre habitats d'Omphiscola glabra situés sur marne ou sur granite afin de préciser le nombre et la taille des pontes au printemps et de suivre la croissance des deux générations annuelles au cours de l'année. Dans les deux types d'habitats, le nombre des pontes par mollusque adulte et le nombre des oeufs par ponte diminuent de manière significative au cours des sept semaines de la période d'oviposition (printemps 2015). Au cours de ces semaines, chaque limnée adulte sur marne dépose 6,4 pontes et 93,3 oeufs en moyenne. Sur granite, les valeurs moyennes sont respectivement de 5,7 pontes et de 69,1 oeufs. Deux générations annuelles, l'une au printemps et l'autre en automne, ont été notées dans ces habitats. Les hauteurs des individus nés sur marne sont significativement plus élevées que celles des mollusques nés sur granite. Il en résulte une taille maximale différente pour les adultes : 19,8 et 20,5 mm en moyenne sur marne au lieu de 17,2 et 18,2 mm sur granite. Deux catégories d'individus, à savoir des juvéniles nés au printemps (3,1 à 3,4 mm en moyenne en juillet) et des limnées adultes nées lors de l'année précédente (au printemps et en automne), subissent le dessèchement estival de leurs habitats. La différence existant entre les hauteurs de coquille sur marne et sur granite pourrait s'expliquer en partie par la teneur en ions calcium dissous dans l'eau courante (26-35 mg/L sur marne au lieu de teneurs inférieures à 20 mg/L sur granite).
Field investigations in four Omphiscola glabra populations living on marl or granite were carried out during 12 months to specify the number and size of egg-deposits in spring, and follow the shell growth of both generations over the year. In both types of habitats, the number of egg-masses per adult snail and their size significantly decreased during the seven weeks of snail egg-laying (spring 2015). During this period, each adult snail on marl laid a mean of 6.4 egg-masses and 93.3 eggs. On granite, the respective mean values were 5.7 egg-deposits and 69.1 eggs. Two annual generations, the first in spring and the other in autumn, were noted in these habitats. Shell heights of snails hatched on marl were significantly higher than those of snails living on granite. Consequently, the maximal shell height of adults was different : a mean of 19.8 and 20.5 mm on marl instead of 17.2 and 18.2 mm on granite. Two snail categories, i.e. spring-born juveniles (a mean of 3.1-3.4 mm in July) and adults born during the previous year (in spring and autumn), were subjected to summer drying of their habitats. The difference between the shell heights recorded on marl and granite might partly be explained by the dissolved calcium level in running water (26-35 mg/L on marl instead of levels lower than 20 mg/L on granite).
Introduction
La Limnée étroite, connue aussi sous le nom scientifique d'Omphiscola glabra, a une aire de répartition limitée dans l'Europe de l'Ouest car les populations de cette espèce se distribuent depuis le sud de la Scandinavie jusqu'au sud de l'Espagne (Prié et al., 2011). Cette limnée colonise le plus souvent des habitats à dessèchement périodique et a une préférence pour les sols acides (Prié et al., 2011). Dans le Limousin, on rencontre principalement cette espèce dans les systèmes de drainage superficiel présents dans les prairies marécageuses et les fossés de route (Vareille-Morel et al., 1999, 2007). Beaucoup de recherches ont été réalisées par notre équipe sur le rôle que la limnée joue comme hôte intermédiaire dans le cycle évolutif de plusieurs Digènes (Abrous et al., 1999, 2000 ; Dreyfuss et al., 2003 ; Rondelaud et al., 2015 ; Vignoles et al., 2016). Par contre, l'écologie de cette espèce est encore peu connue.
Comme les populations de cette limnée présentent, à l'heure actuelle, un déclin dans le nombre et la taille de ses populations sur toute son aire de répartition (Prié et al., 2011 ; Welter-Schultes, 2013), l'espèce a été inscrite sur les Listes rouges nationales des espèces menacées comme un taxon en danger critique d'extinction en Irlande, une espèce en danger en Allemagne et une limnée vulnérable en Grande-Bretagne, aux Pays-Bas et en Suède (Byrne et al., 2009 ; Welter-Schultes, 2013). En Ecosse, un programme de sauvegarde a été mis en place pour maintenir et, lorsque cela est possible, augmenter la taille des populations et la distribution de cette limnée (Macadam et Baker, 2005 ; Baker, 2013). L’un des objectifs fixés par ces auteurs est de déterminer ce qui constitue un bon habitat pour la Limnée étroite (Macadam, 2006). La connaissance de l'écologie chez cette espèce est donc essentielle.
Les premières investigations réalisées par Rondelaud et al. (2003) ont montré qu'il existe des différences entre les populations d'O. glabra par rapport à l'estivation. Dans le Parc Naturel Régional de la Brenne, département de l'Indre, la plupart des mollusques estivent en s'enfouissant dans la marne. Par contre, sur les sols granitiques de la Haute-Vienne, aucun enfouissement n'a été noté et les mollusques subissent le dessèchement estival de leurs habitats en se fixant sur une plante ou un élément minéral, avec leur ouverture étroitement appliquée sur ce substrat. Dans les deux cas, des mollusques adultes survivent à ce processus et meurent dans les semaines qui suivent les premières pluies post-estivales (Rondelaud et al., 2003). La différence, que l'on note dans l'estivation de ces limnées par rapport à la géologie du sous-sol, a également été retrouvée dans la hauteur maximale des mollusques adultes. D'après Dreyfuss et al. (2010), la hauteur moyenne des limnées à la fin de leur vie se situe entre 19,2 et 20,8 mm dans les habitats localisés dans le Parc Naturel Régional de la Brenne alors qu'elle est comprise entre 15,1 et 17,1 mm dans les habitats de la Haute-Vienne. Devant ces deux types de résultats, nous nous sommes demandé si cette influence du sous-sol ne retentissait pas sur les autres fonctions de la limnée et en particulier sur son activité reproductrice. Nous nous sommes donc posé les deux questions suivantes : est-ce que la reproduction d'O. glabra présente des différences par rapport à la localisation des limnées sur marne ou sur granite ? Comment s'effectue la croissance de la coquille sur ces deux types de sols ? Pour répondre à la première question, des investigations hebdomadaires ont été effectuées de février à juin 2015 dans quatre habitats à raison de deux sites sur marne et les deux autres sur granite afin de préciser plusieurs paramètres de l'activité reproductrice au cours de la principale période de pontes (au printemps). La réponse à la seconde question a été réalisée en pratiquant des prélèvements mensuels de mollusques dans les quatre habitats pendant 12 mois (de janvier à décembre 2015) pour suivre la croissance de la coquille d'O. glabra au cours de l'année.
Matériel et méthodes
1. Les habitats des mollusques
Les deux premières populations d'O. glabra vivent dans le Parc Naturel Régional de la Brenne sur les communes de Chitray (46°40’17" N, 1°18'3" E) et de Thenay (46°34’47" N, 1°24’34" E), département de l'Indre. Ces habitats sont situés dans des fossés de route et leur superficie respective en janvier 2015 est de 15,4 et de 75,6 m2. Les eaux de ruissellement en provenance des prairies proches inondent ces sites depuis la fin d'octobre jusqu'au mois de juin. Leur substratum est composé de sable et de limons, le tout reposant sur une couche imperméable de marne. Le pH de l'eau varie de 6,7 à 7,8 au cours de l'année en fonction des apports et la teneur en ions calcium dissous se distribue entre 26 et 35 mg/L (Dreyfuss et al., 2010). De nombreuses touffes de joncs et quelques potamots poussent dans ces deux habitats. On y trouve aussi de nombreux restes de plantes mortes tout au long de l'année et des algues filamenteuses épiphytiques au printemps.
Les deux autres populations colonisent aussi des fossés de route sur les communes de Blond (46°2’26" N, 1°1’41" E) et du Dorat (46°11’52" N, 1°4’6" E), département de la Haute-Vienne. Les superficies respectives de leurs habitats sont de 30,5 et de 10,9 m2 en janvier 2015. Dans chaque site, une source temporaire fournit de l'eau depuis la fin du mois d'octobre jusqu'au mois de juillet. Le pH de cette eau varie de 5,6 à 7 au cours de l'année et la teneur en ions calcium dissous ne dépasse pas 20 mg/L (Guy et al., 1996).
Ces quatre habitats sont soumis aux mêmes conditions avec un climat continental humide modulé par les vents qui viennent de l'Océan Atlantique. La pluviométrie moyenne annuelle au cours des trente années précédant ces investigations varie de 600 à 1000 mm selon les années, tandis que la température moyenne annuelle est de 10° ou de 11° C (Dreyfuss et al., 2010 ; Rondelaud et al., 2011).
2. Les pontes du mollusque
Des relevés hebdomadaires ont été réalisés dans ces stations en utilisant la méthode des quadrats. Des aires de 1 m2 chacune ont été choisies dans les habitats de Blond et Thenay (cinq par station) ; par contre, leur nombre n'est que de trois dans chacun des deux autres sites. Ces zones ont été inventoriées pendant les sept semaines de la période de pontes et étaient toutes situées dans des secteurs soumis à la lumière du soleil au moins deux heures par jour (les pontes sont rares dans les lieux qui sont toujours à l'ombre). De l'eau sur cinq centimètres de profondeur ou moins recouvre le fond de ces quadrats car le comptage des pontes est difficile dans les zones plus profondes. Les limnées adultes (12 mm et plus en hauteur) et les pontes ont d'abord été décomptées dans chaque quadrat pendant 35 à 40 min. Vingt mollusques adultes ont été ensuite récoltés et leur hauteur de coquille a été mesurée à l'aide d'un pied à coulisse électronique avant que ces individus ne soient replacés dans leur milieu. Dix pontes ont été enfin prélevées pour être transportées au laboratoire. Les autres ont été enlevées du quadrat pour éviter qu'elles ne soient recomptées sept jours plus tard. Au laboratoire, les pontes récoltées sur le terrain ont été plongées dans de l'eau de source et placées dans une pièce sous les conditions suivantes : température variant chaque jour de 8°-12° C à 22°-24° C, photopériode naturelle et incidence indirecte de la lumière du soleil. Le nombre des œufs par ponte, la longueur de la période d'incubation et le taux de fécondité ont alors été déterminés.
Les quatre premiers paramètres sont i) la durée de la période de pontes au printemps, ii) la densité des limnées adultes, iii) celle des pontes et iv) le rapport entre le nombre des pontes et l'effectif des limnées adultes. Les trois autres sont le nombre des œufs par ponte, la longueur de la période d'incubation et le taux de fécondité (nombre de nouveau-nés qui éclosent à partir des pontes par rapport au nombre des œufs présents dans celles-ci). Les valeurs relevées pour chaque paramètre ont été ramenées à une moyenne, encadrée d'un écart-type, en tenant compte de la géologie du sous-sol (marne ou granite) et de la durée de la période de pontes. La normalité de ces valeurs a été analysée avec le test de Shapiro et Wilk (Shapiro et Wilk, 1965). Comme leur distribution n'était pas normale, le test de Kruskal-Wallis a été utilisé pour établir les niveaux de signification statistique. Toutes les analyses ont été réalisées avec le logiciel Statview 5.0 (SAS Institute Inc., Cary, NC, USA).
3. Croissance des limnées dans le temps
De janvier à juin et de septembre à décembre 2015, des échantillons de 100 limnées ont été prélevés chaque mois dans les quatre habitats. Aucune récolte de mollusques n'a été effectuée en juillet et en août 2015 en raison du dessèchement estival des stations. La hauteur des O. glabra a été mesurée à l'aide d'un pied à coulisse électronique. Les limnées sont replacées ensuite dans leur habitat.
Les valeurs individuelles de ce paramètre ont été centrées et les écarts types ont été calculés en tenant compte de la géologie du sous-sol, de la génération de la limnée et de la date de la récolte. La normalité de ces valeurs a été aussi analysée avec le test de Shapiro et Wilk (Shapiro et Wilk, 1965). Comme leur distribution n'était pas normale, nous avons utilisé le test de Kruskal-Wallis pour établir les niveaux de signification statistique. Toutes les analyses ont été effectuées avec le logiciel Statview 5.0 (SAS Institute Inc., Cary, NC, USA).
Les graphes de la figure 1 ont été construits i) en regroupant les valeurs relevées de janvier à décembre 2015 pour chaque type d'habitat (sur marne ou sur granite) et ii) en tenant compte de la date des prélèvements.
Résultats
1. Caractéristiques des pontes
Tableau 1. Effectif de limnées adultes (> 12 mm en hauteur) et nombre de pontes dans quatre habitats colonisés par Omphiscola glabra par rapport à la géologie du sous-sol et à la durée de la période de pontes (printemps 2015).
|
Période de pontes |
Densité/m2 d'habitat : moyenne ± écart type |
Pontes par limnée adulte* |
||||
|
Limnées adultes |
Pontes |
|||||
|
Marne |
Granite |
Marne |
Granite |
Marne |
Granite |
|
|
Semaine 1 |
32,1 ± 9,3 |
17,2 ± 5,1 |
27,6 ± 11,0 |
22,1 ± 9,0 |
0,85 |
1,29 |
|
Semaine 2 |
35,6 ± 11,3 |
18,8 ± 6,0 |
45,3 ± 13,7 |
22,3 ± 8,4 |
1,27 |
1,18 |
|
Semaine 3 |
33,5 ± 8,3 |
16,5 ± 4,5 |
41,2 ± 12,5 |
18,1 ± 5,1 |
1,22 |
1,09 |
|
Semaine 4 |
29,4 ± 10,2 |
16,8 ± 5,3 |
31,2 ± 9,5 |
12,2 ± 3,6 |
1,06 |
0,72 |
|
Semaine 5 |
24,3 ± 9,5 |
14,3 ± 4,7 |
19,5 ± 7,3 |
9,1 ± 3,2 |
0,80 |
0,63 |
|
Semaine 6 |
19,2 ± 8,2 |
13,9 ± 3,9 |
14,3 ± 7,1 |
7,3 ± 2,5 |
0,74 |
0,52 |
|
Semaine 7 |
15,6 ± 5,3 |
9,2 ± 3,1 |
8,2 ± 2,4 |
3,2 ± 1,5 |
0,52 |
0,34 |
* Nombre total de pontes par limnée adulte : 6,46 (marne), 5,77 (granite).
Dans les quatre habitats, la période de pontes au printemps dure sept semaines. Les premières pontes ont été déposées à la fin avril 2015 et les dernières ont été trouvées à la mi-juin 2015. La hauteur moyenne des limnées adultes sur marne est de 19,5 ± 1,7 mm dans la population de Chitray et de 20,6 ± 0,9 mm dans celle de Thenay à la fin de la période des pontes. Dans les habitats sur granite, les valeurs respectives sont de 16,3 ± 1,4 mm à Blond et de 17,2 ± 0,8 mm au Dorat. La hauteur de ces limnées adultes à la septième semaine est significativement plus élevée (H = 14,67 ; p < 0,1 %) sur marne que sur granite. Par contre, les valeurs notées dans chaque type d'habitat ne présentent pas de différence significative entre elles (données non représentées).
La densité des limnées adultes et celle des pontes dans les deux types d'habitats (sur marne ou sur granite) sont répertoriées sur le tableau I par rapport à la durée des pontes. Le nombre des mollusques adultes par mètre carré d'habitat montre un pic au cours de la deuxième semaine et diminue par la suite jusqu'à la fin de la période d'oviposition. Lors de la deuxième semaine, ces adultes sont significativement plus nombreux (H = 7,58 ; p < 1 %) dans les habitats sur marne que dans les deux autres sites. A partir de la troisième semaine, la diminution dans les densités de limnées adultes est significativement plus grande (H = 7,79 ; p < 1 %) dans les gîtes sur granite. Des résultats similaires ont également été notés pour la densité des pontes au cours des sept semaines. Lors de la deuxième semaine, le nombre des pontes est significativement plus important (H = 9,01 ; p < 1 %) dans les habitats sur marne. Par contre, la diminution, que l'on note dans les densités de ces pontes à partir de la troisième semaine, est significativement plus rapide (H = 10,54 ; p < 1 %) sur granite. Ce dernier résultat est renforcé par le rapport entre la densité des pontes et celle des limnées adultes : de 1,27 à 0,17 ponte au cours des sept semaines dans les habitats sur granite (au lieu de 1,29 à 0,34 ponte sur marne). Si l'on additionne les nombres de pontes qui ont été déposées chaque semaine par chaque limnée, le total est de 6,46 pontes sur marne au lieu de 5,77 sur granite.
Tableau II. Nombre des œufs par ponte et taux de fécondité dans quatre populations de limnées par rapport à la géologie du sous-sol et la durée de la période d'oviposition.
|
Période de pontes |
Nombre des œufs par ponte*/** |
Taux de fécondité |
||
|
Marne |
Granite |
Marne |
Granite |
|
|
Semaine 1 |
15,6 ± 5,4 |
12,5 ± 4,2 |
100 % |
100 % |
|
Semaine 2 |
16,3 ± 5,2 |
13,1 ± 4,2 |
100 % |
100 % |
|
Semaine 3 |
15,1 ± 5,5 |
13,0 ± 5,1 |
100 % |
100 % |
|
Semaine 4 |
14,3 ± 4,3 |
12,1 ± 4,2 |
100 % |
100 % |
|
Semaine 5 |
13,2 ± 4,1 |
11,6 ± 4,5 |
100 % |
97,5 % |
|
Semaine 6 |
12,5 ± 4,1 |
9,3 ± 3,7 |
99,8 % |
88,1 % |
|
Semaine 7 |
11,5 ± 3,9 |
8,1 ± 3,8 |
96,2 % |
84,3 % |
* Valeur moyenne ± écart type.
** Nombre total des œufs par limnée adulte : 93,3 (marne), 69,1 (granite).
Dans les deux types d'habitats, le nombre des œufs par ponte (Tableau II) montre un pic au cours de la deuxième semaine et diminue par la suite. Les pontes récoltées dans les habitats sur marne contiennent davantage d'œufs (H = 6,35 ; p < 5 %) que celles provenant des sites sur granite (une moyenne de 15,6 œufs, par exemple, au cours de la première semaine au lieu de 12,5 œufs). Par contre, la diminution, que l'on note dans la taille de ces pontes, est significativement plus importante (H = 8,32 ; p < 1 %) sur granite. Si l'on totalise les œufs au cours des sept semaines, chaque limnée adulte dépose 93,3 œufs en moyenne dans un habitat sur marne (au lieu de 69,1 œufs dans un site sur granite).
La longueur de la période d'incubation dans les conditions du laboratoire va de 10,7 ± 2,1 jours à 11,8 ± 1,6 jours, quelle que soit l'origine des pontes (données non représentées). Le taux de fécondité (Tableau II) diminue légèrement à partir de la cinquième semaine pour les pontes récoltées dans les habitats sur granite et de la sixième semaine pour celles qui proviennent des sites sur marne. Ce dernier résultat est dû à la présence d'œufs non fécondés dans ces pontes.
2. Croissance de la coquille
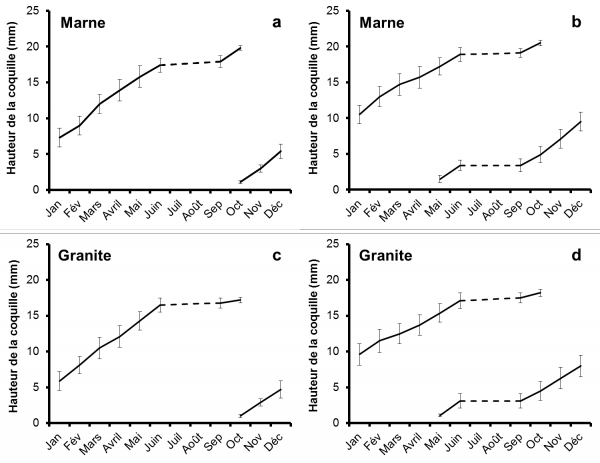
La figure 1 montre l'évolution de la hauteur de coquille au cours de l'année par rapport à l'origine géographique des habitats (sur marne ou sur granite) et la génération du mollusque.
Figure 1. Croissance de la coquille d'Omphiscola glabra dans les habitats sur marne et sur granite : individus nés en automne (a, c) et au printemps (b, d).
Deux périodes de croissance, à savoir au printemps et en automne, ont été notées sur le terrain et la plus importante d’entre elles se situe de mars à mai. Par contre, la croissance de la coquille est stoppée au cours du dessèchement estival et est ralentie au cours de l’hiver. Les deux générations de mollusques montrent des différences :
-
Les nouveau-nés de la génération d'automne (Fig. 1a, c) apparaissent en octobre et leur hauteur de coquille s'accroît jusqu'à 5,4 mm en moyenne (sur marne) ou 4,7 mm (sur granite) en décembre. La croissance est légèrement ralentie en janvier (7,3 mm en moyenne sur marne, 5,9 mm sur granite) et s'accroît à partir de février jusqu'à la hauteur moyenne de 17.4 mm (sur marne) ou de 16,5 mm (sur granite) en juin. Lors de la survenue des premières pluies post-estivales, les individus, qui survivent, meurent en octobre avec une hauteur maximale de 19,8 mm en moyenne sur marne et de 17,2 mm sur granite. Dans les relevés effectués de novembre à juin, il y a toujours une différence entre la croissance des limnées nées sur marne et celle des individus qui vivent sur granite. Par contre, les valeurs relevées en septembre et octobre pour les limnées adultes ne présentent pas de différence significative entre elles.
-
Les pontes déposées au printemps par les individus de la génération d'automne sont à l'origine d'une autre vague de nouveau-nés qui naissent au mois de mai. La hauteur moyenne de ces individus s'accroît jusqu'à 3,4 mm (sur marne) ou 3,1 mm (sur granite) en juin si bien qu'ils subissent le dessèchement estival à l'état juvénile. En septembre, la croissance des survivants reprend jusqu'à la valeur moyenne de 9,5 mm (sur marne) ou de 8 mm (sur granite) en décembre. Après un léger ralentissement de la croissance en janvier, on note une reprise de celle-ci au printemps pour aboutir en juin à une moyenne de 18,9 mm (sur marne) ou de 17,4 mm (sur granite) en juillet. Les quelques individus qui survivent au dessèchement estival, meurent en septembre ou en octobre avec une hauteur maximale de 20,5 mm en moyenne (sur marne) ou de 18,2 mm. Comme pour la génération transhivernante, il existe aussi une différence entre la croissance des limnées sur marne et celle des individus sur granite depuis les relevés de novembre jusqu'à ceux de juin.
La comparaison des moyennes entre les limnées nées sur marne et sur granite a été réalisée pour les relevés de décembre et de juillet. La hauteur des mollusques vivant sur marne est significativement plus élevée (décembre : H = 13,81, p < 0,1 % ; juillet : H = 8,45, p < 1 %) que celle des individus nés sur granite.
Discussion
D'après Germain (1930-1931) et Macadam (2006), les pontes déposées par O. glabra sont oblongues et sont longues de 10 à 15 mm. Chacune d'entre elles comprend 15 à 30 oeufs avec un diamètre de 0,6 à 0,9 mm et est fixée sur une plante submergée ou un substrat minéral. En fonction de la température ambiante, les nouveau-nés éclosent au bout de 15 à 25 jours. Par contre, les informations sur le comportement de la limnée lors de ses pontes dans ses habitats sont rares. Des résultats discordants ont été notés pour la date des premières pontes : à partir de la mi-février (Macadam, 2006) ou du mois de mai (Welter-Schultes, 2013). Les autres points comme la densité des pontes dans les habitats de la limnée, leur taille et le taux de fécondité par rapport à la géologie du sous-sol ont été peu étudiés. Des investigations de terrain étaient donc nécessaires afin de préciser ces points au cours de la principale période d'oviposition (au printemps) chez O. glabra.
La plupart des résultats rapportés dans la présente étude ont été comparés avec ceux que Vareille-Morel et al. (1998) ont publiés sur les populations d'une autre limnée, Galba truncatula lorsqu'elles vivent sur le même type de sols. Tout d'abord, on note une diminution dans le nombre des pontes tout au long de la période d'oviposition au printemps, quelle que soit l'espèce de la limnée. Ce résultat est principalement dû au fait que les limnées adultes atteignent leur hauteur maximale au cours de cette période et meurent. Cependant, une autre explication basée sur une production d'œufs plus élevée au cours des premières semaines, suivie par une diminution au cours des semaines suivantes, ne peut être complètement exclue. Un argument supportant cette hypothèse est la chute qui se produit dans le nombre des œufs dans chaque ponte au cours des sept semaines (Tableau II). En deuxième lieu, les valeurs relevées pour le nombre des pontes et celui des œufs sont significativement plus importantes dans les habitats sur marne que dans les sites sur granite. Ces différences peuvent être expliquées par la taille des limnées qui est plus élevée dans les habitats sur marne. Cependant, d'autres facteurs peuvent avoir aussi un effet sur le nombre et la taille de ces pontes. Parmi ces derniers, le plus efficient pourrait être le microclimat local car celui-ci est connu pour son influence sur la croissance de la végétation et la biologie du mollusque (Smith et Wilson, 1980). En troisième lieu, la fécondité des œufs pondus par l'une ou l'autre des limnées diminue légèrement au cours des dernières semaines de la période d'oviposition. Ce fait a été également observé par Tapie (1996) chez une autre limnée, Radix labiata ( = R. peregra peregra). La présence de plusieurs œufs non fécondés dans les pontes déposées par O. glabra au cours des sixième et septième semaines pourrait être due à la non viabilité du sperme local ou étranger contenu dans le carrefour du mollusque (de Jong-Brink, 1990). Le stockage du sperme dans cette zone sur une longue période réduirait son pouvoir fécondant si bien que plusieurs spermatozoïdes ne seraient plus capables de pénétrer dans les ovocytes.
Les deux générations annuelles de la Limnée étroite observées dans la présente étude sont en accord avec les rapports de plusieurs auteurs sur le nombre de générations existant chez les Gastéropodes Pulmonés qui vivent dans les habitats de l'Europe de l'Ouest, soumis à un dessèchement périodique (Boycott, 1936 ; Økland, 1990 ; Dillon et al., 2004 ; Glöer et Diercking, 2010). Cependant deux points méritent des commentaires particuliers. Le premier se rapporte à la hauteur de la coquille qui est significativement plus élevée dans les habitats sur marne que dans ceux sur granite. Cette différence doit être rapportée à la géologie du sous-sol. Parmi les éléments qui peuvent avoir une influence, la teneur en ions calcium présents dans l'eau courante ou le sol de ces stations (celle-ci est plus faible dans les habitats sur granite) pourrait être le principal facteur responsable de cette différence. En effet, cet élément minéral est déjà connu pour son effet positif sur la distribution des espèces de mollusques continentaux dans un pays donné (Boycott, 1934), la richesse en espèces (Horsák et Hájek, 2003 ; Juřičková et al., 2008), l’abondance de chaque espèce (Hotopp, 2002 ; Vadeboncoeur et al., 2007) et la croissance des mollusques (Beeby et Richmond, 2007). En deuxième lieu, les individus qui entrent en estivation appartiennent à deux groupes : des juvéniles mesurant en moyenne 3,1 à 3,4 mm et des adultes de taille supérieure à 15 mm (Fig. 1). En raison de leur enfouissement dans le sédiment lors du dessèchement estival, la mortalité des adultes sur marne est moins élevée que celle des mollusques sur granite (Rondelaud et al., 2003). Dans les deux cas, la faible taille des juvéniles leur permet de mieux supporter les effets de l'estivation, quelle que soit la géologie du sous-sol, comme cela a déjà été rapporté pour une autre limnée, G. truncatula (Taylor, 1965).
En conclusion, le nombre et la taille des pontes sont plus élevés dans les habitats d'O. glabra sur marne que dans ceux sur granite. Des résultats similaires ont également été notés pour la croissance de la coquille dans le temps. Ces différences doivent être reliées à la géologie du sous-sol et en particulier à la teneur en ions calcium dissous qui est plus faible sur les sols cristallophylliens que dans les terrains sédimentaires.