Contenu pollinique des miels récoltés dans un champ de Cajanus cajan (L.) Millsp (Fabaceae) dans la commune de Djidja (Bénin) Pollen content of honeys harvested in a field of Cajanus cajan (L.) Millsp (Fabaceae) in the commune of Djidja (Benin)
Isabelle Houéfa KENALI ,
Rodica S.A. ZANOU ,
Adi MAMA ,
Félicien AMAKPE ,
Monique Gbêkponhami TOSSOU ,
Guy A. MENSAH
Akpovi AKOEGNINOU
Le but de ce travail est de rechercher le contenu pollinique et d’évaluer l’importance des pollens de Cajanus cajan (L.) Millsp dans du miel collecté dans un champ de Cajanus cajan, dans la commune de Djida ; au Sud du Bénin. De décembre 2018 à avril 2019, l’inventaire des plantes mellifères sur le site d’étude a été réalisé simultanément à la récolte des miels dans 6 ruches. Au total, 73 espèces mellifères ont été recensées, réparties en 29 familles et en 61 genres. Les familles les mieux représentées sont les Asteraceae, les Sterculiaceae, les Euphorbiaceae, les Arecaceae et les Fabaceae. L’analyse pollinique des six échantillons de miel récoltés a permis de compter 29 226 grains de pollen, répartis en 33 taxons polliniques appartenant à 17 familles et à 36 genres. Les familles dominantes ont été les Fabaceae, les Asteraceae, les Combretaceae et les Euphorbiaceae. La richesse pollinique a varié de 280 à 10 341 pollens et la richesse taxonomique entre 10 et 21 taxons par échantillon de miel. Quant à la représentativité effective des pollens du C. cajan dans les miels, l’échantillon E3 du mois de février a présenté la plus grande proportion (179 grains de pollens) soit 45,33 % ; ainsi que les échantillons E2 (337 grains de pollens) soit 27,45 % et E1 (37 grains de pollens) soit 13,21 %. Ils étaient absents dans les échantillons E4, E5 et E6.
The aim of this work is to investigate the pollen content and evaluate the importance of Cajanus cajan (L.) Millsp pollens in honey collected from a Cajanus cajan field, in the commune of Djida ; Southern Benin. From December 2018 to April 2019, the inventory of melliferous plants at the study site was conducted simultaneously with the collection of honeys from 6 hives. A total of 73 honey-bearing species were recorded, divided into 29 families and 61 genera. The best represented families are Asteraceae, Sterculiaceae, Euphorbiaceae, Arecaceae and Fabaceae. Pollen analysis of the six honey samples collected yielded 29,226 pollen grains, divided into 33 pollen taxa belonging to 17 families and 36 genera. The dominant families were Fabaceae, Asteraceae, Combretaceae and Euphorbiaceae. The pollen richness varied from 280 to 10,341 pollens and the taxonomic richness from 10 to 21 taxa per honey sample. As for the actual representativeness of C. cajan pollens in the honeys, sample E3 from February presented the highest proportion (179 pollens grains) or 45.33 % ; as well as samples E2 (337 pollens grains) or 27.45 % and E1 (37 pollens grains) or 13.21 %. They were absent in samples E4, E5 and E6.
I. Introduction
L’apiculture est l’élevage des abeilles pour la production de miel et autres produits de la ruche. De nos jours, la consommation de miel a augmenté car c’est un produit qui attire les consommateurs grâce à son origine naturelle et à ses vertus notamment anti-oxydantes. Ainsi, les produits issus du travail de cet insecte sont utilisés depuis des millénaires et leurs emplois sont retrouvés dans de très nombreuses civilisations et autres croyances (Canini et al., 2005). Élaboré par les abeilles mellifères, le miel connaît de nos jours une vogue nouvelle après une éclipse momentanée (due à l’introduction de sucre de betteraves au XIXème siècle). Il est produit à partir du nectar/pollen des fleurs ou de sécrétions issues des parties vivantes des plantes appelée miellat (Djossou et al., 2012). En Afrique de l’Ouest, le miel était la seule source abondante de matières sucrées dont on pouvait disposer (Canini et al., 2005). Sa composition varie avec la source florale utilisée par les abeilles, la période de récolte et les conditions géo-climatiques des régions concernées (Canini et al., 2005). Pour Fosto et al. (2014), le meilleur moyen d’accroître la production et la productivité de l’apiculture est d’avoir une bonne connaissance des plantes mellifères. Au Bénin, les travaux menés jusqu’à présent sur les plantes mellifères sont ceux de Yédomonhan (2004) ; Amakpe et al. (2015) respectivement au Sud du Bénin ; dans les régions sylvo-mellifères et au Nord du pays (Ahouandjinou et al., (2017). Parmi ces plantes mellifères, figure C. cajan dont les feuilles possèdent des propriétés antibactériennes, antifongiques, antidiarrhéiques, hypotensives et contre les affections oculaires (Delnatte et Mayer, 2012). Par ailleurs, ses feuilles sont la partie les plus fréquemment employées pour le bétail en période de soudure. Les graines possèdent des propriétés hypoglycémiantes et antidrépanocytaires (N’Draman-Donou et al., 2017).
Ainsi le miel et C. cajan constituent des sources d’alimentation. En outre, la présence des pollens de C. cajan dans le miel ne jouerait-il pas un rôle sur la santé de l’homme vu ses nombreuses vertus ? L’objectif global de l’étude est de montrer la représentativité des pollens de C. cajan dans les miels dans un champ à C. cajan et de voir leur probable effet sur la santé humaine. De façon spécifique, il s’est agi : (1) d’inventorier les plantes mellifères du site apicole de l’ONG-Cercle Nature et Développement ; (2) de déterminer la variation de la composition pollinique des miels du site et de déterminer l’importance des pollens de C. cajan dans les miels par rapport aux contenus polliniques des autres espèces après l’analyse pollinique.
II. Matériel et Méthodes
II.1 Milieu d’étude
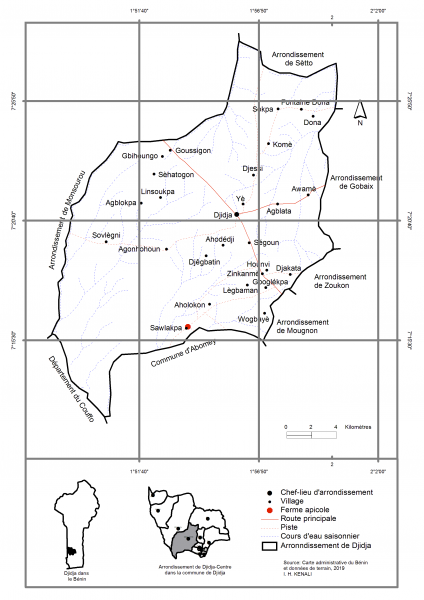
L’étude a été réalisée dans le village de Sawlakpa dans l’arrondissement de Djidja-Centre (figure 1). Il est situé entre 007°20′ 46″au Nord et 001°56′ 8″à l’Est et est limitée au Sud par les communes d’Abomey et de Bohicon, au Sud- Ouest par le département du Couffo, à l’Est par la commune de Za-Kpota et au Nord par le département des Collines. Deux substrats géologiques portent les sols de la commune. Il s’agit du continental terminal qui porte les sols ferralitiques du sud et du socle cristallin du crétacé qui porte les sols ferrugineux. On y retrouve également des vertisols et des sols hydromorphes (Ezin et Seblohondo, 2017). La commune de Djidja jouit d’un climat de type subéquatorial caractérisé par deux saisons pluvieuses et deux saisons sèches au sud et du type soudano-guinéen dans les parties septentrionales. Les formations végétales sont constituées par des savanes arborées et arbustives, des forêts claires, de galeries forestières, des champs et des plantations (Akoègninou et al., 2006). On note aussi, la présence de savanes boisées et de forêts claires dominées par Anogeissus leiocarpa, Pterocarpus erinaceus, puis des plantations de Gmelina arborea, de mosaïques de cultures et des jachères.
Figure 1 : Localisation géographique du site d’étude
II.2 Matériel
Les échantillons de miel récoltés dans le rucher installé dans le champ de C. cajan ont constitué le matériel biologique. Des matériels techniques tels que les instruments de terrain (GPS, sécateur, flacons de conservation des fleurs, papiers journaux, marqueur indélébile, appareil photographique) ; et de laboratoire (centrifugeuse, plaque chauffante, vernis à ongle, lames, lamelles, Microscope ZEISS®, acides (acétique, anhydride et sulfurique), alcool (éthanol et butanol tertiaire) et la gélatine glycérinée (GG) colorée avec de la fuchsine) ont été utilisés.
II.3 Méthodes
L’inventaire exhaustif des espèces mellifères a été réalisé à partir des observations visuelles et directes de décembre 2018 à avril 2019. L’aire d’observation choisie pour le travail a été d’1 km de rayon autour du rucher comme l’ont déjà fait Yédomonhan (2004 et 2009), Coulibaly (2013) et Ahouandjinou (2018).
Les échantillons de miels ont été collectés mensuellement de décembre 2018 à mai 2019. Le rucher étant sur un site expérimental, il a été effectué un seul prélèvement de miel de l’une des six ruches colonisées. Au total, six (06) échantillons de miel ont été obtenus et codés E1 à E6. Ils ont été stockés et conservés dans des tubes de 30 ml de type K1015 hermétiquement fermés. Ils ont été traités par la suite selon la méthode d’acétolyse d’Erdtman (1969) puis analysés au laboratoire à l’aide du microscope ZEISS® SF20. Les identifications et les déterminations ont été effectuées à l’aide des ouvrages d’illustrations des pollens et de spores de Faegri et Iversen (1975) ; Ybert, (1979), Bonnefille et Riollet, (1980) ; Sowunmi, (1973, 1995) ; Clément (2002) ; Schweitzer (2009) ; Chouia (2014).
Les graphiques et les tableaux ont été réalisés grâce au tableur Excel 2010.
La diversité floristique est évaluée à l’aide de la richesse spécifique, de la diversité en genres et en familles (Daget, 1980). Elle se définit comme le nombre total d’espèces végétales dans une formation (Yédomonhan, 2009). La nomenclature botanique utilisée a été celle de Akoègninou et al. (2006).
La richesse spécifique et la richesse pollinique ont été également calculés. La richesse spécifique est le nombre de taxons représentatif par échantillon de miel et la richesse pollinique est le nombre total des grains de pollen comptés (Lobreau-Callen et al., 1986). Elle permet de calculer les taux polliniques et d’obtenir le spectre pollinique de miel par échantillon. Cette somme pollinique tient compte du nombre total de pollens (déterminés et indéterminés).
La richesse taxonomique (Rt) d’un miel est le nombre total des taxa polliniques déterminés dans un échantillon de miel. Elle prend en compte tous les taxa identifiés soit au niveau de l’espèce, soit au niveau du genre ou au niveau de la famille. Suivant cette diversité taxonomique des miels, quatre classes de miel ont été distinguées d’après la formule adaptée de Lobreau-Callen et Damblon (1994) ; il s’agit de : miel très pauvre (moins de 5 taxons), miel pauvre (5 à 15 taxons), miel diversifié (jusqu’à 50 taxons). On admet communément que cette richesse taxonomique à déterminer par échantillon de miel doit être au moins égale à 20 (Koudégnan, 2015). La nomenclature botanique utilisée est celle d’Akoègninou et al. (2006).
III. Résultats et discussion
Diversité floristique des plantes mellifères inventoriées sur le site et autour du rucher
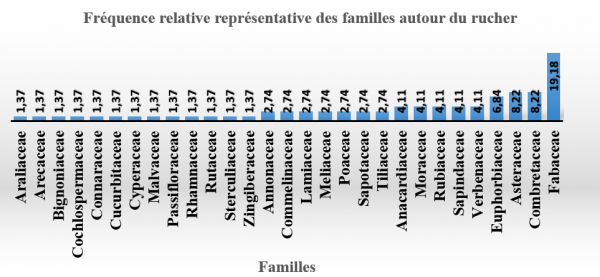
Au total 73 plantes mellifères ont été recensées sur le site autour du rucher (tableau 1). Elles ont été réparties en 29 familles et en 61 genres. Cette valeur de richesse spécifique est inférieure à celle trouvée par Yédomonhan (2009) qui avait inventorié 216 plantes mellifères dans la forêt classée de la Lama et 266 espèces à Manigri ; puis par Zanou (2016) qui avait inventorié 149 espèces sur les sites de Cobly, Kouandé et Tanguiéta (Atacora). Ceci peut s’expliquer par le fait que le travail a été fait pendant l’harmattan et lors de la saison sèche de novembre à avril dans la commune de Djidja qui abrite le site d’étude (ASECNA, 2015). Les familles dominantes ont été les Fabaceae avec 14 espèces, soit 19,18 %, les Asteraceae, les Combretaceae avec chacune six espèces, soit 8,22 %.
Elles sont suivies des Euphorbiaceae avec cinq espèces, soit 6,84 % puis viennent les Anacardiaceae, les Moraceae, les Sapindaceae, les Verbenaceae et les Rubiaceae avec chacune trois espèces, soit 4,11 %, suivies par les Commelinaceae, les Annonaceae, les Lamiaceae, les Meliaceae, les Tiliaceae, les Sapotaceae et les Poaceae avec deux espèces chacune, soit 2,74 % et enfin les Rutaceae, les Bignoniaceae, les Zingiberaceae, les Araliaceae, les Arecaceae, les Cochlospermaceae, les Connaraceae, les Cucurbitaceae, les Cyperaceae, les Malvaceae, les Passifloraceae, les Rhamnaceae et les Sterculiaceae avec une espèce chacune, soit 1,37 % (figure 2).
Figure 2 : Richesse des familles dominantes des espèces autour du rucher
Tableau 1. Liste des espèces inventoriées sur le site autour du rucher
|
Espèces |
Familles |
Types biologiques |
|
Acacia amythethophylla |
Fabaceae |
mPh |
|
Acacia auriculiformis |
Fabaceae |
mPh |
|
Afzelia africana |
Fabaceae |
mPh |
|
Albizia lebbek |
Fabaceae |
mPh |
|
Anacardium occidentale |
Anacardiaceae |
mPh |
|
Anogeissus leiocarpa |
Combretaceae |
mPh |
|
Aspilia africana |
Asteraceae |
Th |
|
Azadirachta indica |
Meliaceae |
mPh |
|
Berlinia grandifolia |
Lef./papilionoideae Fabaceae |
mPh |
|
Blighia sapida |
Sapindaceae |
mPh |
|
Cajanus cajan |
Fabaceae |
mph |
|
Chlorophora excelsa |
Moraceae |
MPh |
|
Chromolaena odorata |
Asteraceae |
Th |
|
Citrus sinensis |
Rutaceae |
mph |
|
Cochlospermum tinctorium |
Cochlospermaceae |
G |
|
Cola cordifolia |
Sterculiaceae |
mPh |
|
Combretum ghazalense |
Combretaceae |
Th |
|
Combretum molle |
Combretaceae |
mPh |
|
Combretum nigritum |
Combretaceae |
mph |
|
Combretum sp |
Combretaceae |
mph |
|
Commelina benghalensis |
Commelinaceae |
Hc |
|
Commelina forskalaei |
Commelinaceae |
Hc |
|
Costus afer |
Zingiberaceae |
G |
|
Cussonia arborea |
Araliaceae |
mph |
|
Cynodon dactylon |
Poaceae |
Hc |
|
Cyperus rodundus |
Cyperaceae |
G |
|
Daniellia oliveri |
Fabaceae |
mPh |
|
Deinbollia pinnata |
Sapindaceae |
Lmph |
|
Desmodium indicum |
Fabaceae |
Ch |
|
Elaeis guineensis |
Arecaceae |
mph |
|
Eupatorium odoratum |
Asteraceae |
Th |
|
Euphorbia heterophylla |
Euphorbiaceae |
Ch |
|
Euphorbia hirsutum |
Euphorbiaceae |
Th |
|
Ficus sp |
Moraceae |
mPh |
|
Ficus sur |
Moraceae |
mPh |
|
Fluggea virosa |
Euphorbiaceae |
nph |
|
Gardenia erubescens |
Rubiaceae |
nph |
|
Gardenia ternifolia |
Rubiaceae |
nph |
|
Gmelina arborea |
Verbenaceae |
mPh |
|
Grewia mollis |
Tiliaceae |
mph |
|
Hexalobus monopetalus |
Annonaceae |
mph |
|
Hymenocardia acida |
Euphorbiaceae |
mph |
|
Hyptis suaveolens |
Lamiaceae |
Th |
|
Keetia multiflora |
Rubiaceae |
mph |
|
Lactuca taraxacifolia |
Asteraceae |
Th |
|
Lannea barteri |
Anacardiaceae |
mph |
|
Lonchocarpus sericeus |
Fabaceae |
mPh |
|
Mallotus oppositifolius |
Euphorbiaceae |
Ch |
|
Mangifera indica |
Anacardiaceae |
mph |
|
Milletia thonningii |
Fabaceae |
mPh |
|
Momordica scarabia |
Cucurbitaceae |
Th |
|
Parkia biglobosa |
Fabaceae |
mPh |
|
Passiflora foetida |
Passifloraceae |
LTh |
|
Paullinia pinnata |
Sapindaceae |
Lmph |
|
Pennisetum polystachion |
Poaceae |
Th |
|
Piliostigma thonningii |
Fabaceae |
mph |
|
Pouteria alnifolia |
Sapotaceae |
mph |
|
Pseudocedrela kotschyi |
Meliaceae |
mPh |
|
Pterocarpus erinaceus |
Fabaceae |
mPh |
|
Pterocarpus santalinoïdes |
Fabaceae |
mPh |
|
Rouera coccinea |
Connaraceae |
LCh |
|
Sida acuta |
Malvaceae |
Ch |
|
Solenostemon morris |
Lamiaceae |
Th |
|
Stereospermum kunthianum |
Bignoniaceae |
mph |
|
Tectona grandis |
Verbenaceae |
mPh |
|
Terminalia avicenioides |
Combretaceae |
mph |
|
Tridax procumbens |
Asteraceae |
Th |
|
Triumfetta pentandra |
Tiliaceae |
nph |
|
Uvaria chamae |
Annonaceae |
mph |
|
Vernonia cinerea |
Asteraceae |
Th |
|
Vitellaria paradoxa |
Sapotaceae |
mPh |
|
Vitex doniana |
Verbenaceae |
mPh |
*Légende : Mégaphanérophytes (MPh) ; Mésophanérophytes (mPh) ; Microphanérophytes (mph) ; Nanophanérophytes (nph) ; Hémicrytophytes (Hc) ; Géophytes (G) ; Thérophytes (Th).
Variation de la composition pollinique des miels du site
● Richesse pollinique (Rp) et Spectre pollinique (Sp)
Les analyses polliniques des six échantillons de miel ont permis d’identifier 33 taxa appartenant à 17 familles (tableau 2). Cette diversité spécifique est sensiblement égale à celle obtenue lors des travaux antérieurs où 32 taxons polliniques ont été trouvés par Fohounfo (2002) dans les miels d’Ewé-Kétou dans la zone guinéenne du Bénin. Par contre, elle est largement inférieure aux 78 taxons trouvés par Dongock et al. (2004) dans les miels de la zone soudano-guinéenne à l’Ouest du Cameroun, aux 121 taxons déterminés par Tossou et al. (2005) dans les miels de la forêt classée de la Lama au Sud du Bénin, ou aux 45 taxons trouvés dans les miels de l’arrondissement de Manigri en zone soudano-guinéenne au Bénin Tossou et al. (2011). Cette différence de diversité taxonomique peut être liée au nombre d’échantillons de miel analysés, à leur période de récolte et à la diversité floristique des types de formations végétales ayant servi de source de butinage aux abeilles (Sowunmi, 1976 ; Agwu et al., 1989). Elle peut être également liée à la superficie de la zone d’étude ainsi qu’aux différences existant entre les zones agro-écologiques et écologiques. Les familles les mieux représentées étaient les Asteraceae, les Sterculiaceae, les Euphorbiaceae, les Fabaceae et les Arecaceae (tableau 2). Ces taxons polliniques, ont été déterminés de la manière suivante : 20 taxa ont été identifiés jusqu’au niveau de l’espèce, soit un taux de 57,14 % ; 11 taxa jusqu’au niveau de la famille, soit un taux de 31,43 % ; 3 taxa jusqu’au niveau du genre, soit un taux de 8,57 %. Les indéterminés représentés par un taux de 2,86 %. La richesse pollinique a donné un total de 29 226 pollens dans les six échantillons de miel. Par échantillon, une nette variation a été notée dépendant strictement des activités de butinage des abeilles mellifères autour du rucher.
● Richesse spécifique (Rs) et Richesse taxonomique (Rt)
A priori, la richesse spécifique était relativement proche de la richesse taxonomique. Ainsi, le degré de détermination spécifique (DDs) a varié en fonction des différents échantillons de miel analysés. Au total, la richesse taxonomique a varié de 10 à 21 taxa tandis que la richesse spécifique a varié de 7 à 15 espèces. Les échantillons de miels E4 et E6 sont donc moyennement riches en taxons, suivis des échantillons E1, E3, E2 et E5 qui étaient pauvres en taxons. Néanmoins tous les échantillons ont eu un bon degré de détermination spécifique (tableau 3).
Par échantillon, les grains de pollens ont varié de 280 à 10 341 pollens. Des six échantillons, la valeur la plus basse (Vb) a été celle de l’échantillon E1 avec 280 pollens et la valeur la plus élevée (Ve) a été celle de l’échantillon E6 avec 10 341 pollens (tableau 3). La richesse taxonomique et la richesse spécifique ont varié d’un échantillon de miel à un autre. Cette valeur optimale obtenue est supérieure à celle obtenue par Tossou et al. (2011) avec les miels vendus sur les marchés de Cotonou au Bénin qui varient entre 1 200 et 2 500 grains de pollen par échantillon. Ceci peut s’expliquer par le fait que le recouvrement de la densité/ha de répartition des Asteraceae (Tridax procumbens) qui était radicalement élevé ; soit 8568,4/ha avec 1516,5/ha de proportion de floraison.
Tableau 2. Spectre pollinique des échantillons de miel analysés
|
N° |
Liste des taxa |
E1 |
E2 |
E3 |
E4 |
E5 |
E6 |
Total (grains de pollens comptés) |
Taux ( %) |
|
1 |
Acacia auriculiformis (Fabaceae) |
0 |
0 |
0 |
1 |
0 |
0 |
1 |
0,003 |
|
2 |
Afzelia africana (Fabaceae) |
0 |
0 |
0 |
0 |
20 |
6 |
26 |
0,088 |
|
3 |
Anacardiaceae |
0 |
0 |
0 |
0 |
18 |
65 |
83 |
0,284 |
|
4 |
Aspilia africana/Tridax procumbens (Asteraceae) |
50 |
703 |
144 |
7467 |
3755 |
7757 |
19876 |
68,007 |
|
5 |
Azadirachta indica (Meliaceae) |
0 |
0 |
0 |
3 |
0 |
2 |
5 |
0,017 |
|
6 |
Fabaceae |
0 |
2 |
1 |
1 |
0 |
1 |
7 |
0,038 |
|
7 |
Cajanus cajan (Fabaceae) |
37 |
337 |
179 |
0 |
0 |
0 |
553 |
1,893 |
|
8 |
Cardiospermun halicacabum (Sapindaceae) |
0 |
0 |
2 |
0 |
3 |
1 |
6 |
0,02 |
|
9 |
Cassia sp (Fabaceae) |
3 |
0 |
5 |
12 |
0 |
0 |
20 |
0,069 |
|
10 |
Combretaceae |
0 |
0 |
2 |
20 |
0 |
8 |
30 |
0,103 |
|
11 |
Daniella oliveri (Fabaceae) |
32 |
118 |
22 |
93 |
0 |
0 |
265 |
0,91 |
|
12 |
Ebenaceae |
0 |
0 |
1 |
0 |
0 |
0 |
1 |
0,003 |
|
13 |
Elaeis guineensis (Arecaceae) |
0 |
33 |
15 |
216 |
37 |
162 |
463 |
1,584 |
|
14 |
Euphorbiaceae |
3 |
19 |
19 |
97 |
0 |
588 |
726 |
2,485 |
|
15 |
Gardenia ternifolia (Rubiaceae) |
0 |
2 |
0 |
1 |
0 |
0 |
3 |
0,01 |
|
16 |
Fabaceae |
2 |
4 |
0 |
1 |
1 |
0 |
8 |
0,028 |
|
17 |
Lamiaceae |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
0,003 |
|
18 |
Malvaceae |
0 |
0 |
4 |
61 |
8 |
16 |
89 |
0,305 |
|
19 |
Newbouldia laevis (Bignoniaceae) |
5 |
2 |
0 |
1 |
0 |
2 |
10 |
0,035 |
|
20 |
Poaceae undiff |
4 |
3 |
1 |
10 |
1 |
6 |
25 |
0,086 |
|
21 |
Psychotria sp (Rubiaceae) |
0 |
0 |
0 |
0 |
0 |
5 |
5 |
0,018 |
|
22 |
Pterocarpus erinaceus (Fabaceae) |
143 |
0 |
0 |
0 |
0 |
0 |
143 |
0,49 |
|
23 |
Rubiaceae |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
0,003 |
|
24 |
Sterculia sp. (Sterculiaceae) |
0 |
0 |
0 |
0 |
5106 |
1694 |
6800 |
23,266 |
|
25 |
Talinum triangulare (Portulacaceae) |
1 |
3 |
0 |
2 |
12 |
15 |
33 |
0,112 |
|
26 |
Gmelina arborea (Verbenaceae) |
0 |
0 |
0 |
13 |
1 |
2 |
16 |
0,054 |
|
27 |
Vitellaria paradoxa (Sapotaceae) |
0 |
0 |
0 |
1 |
0 |
0 |
1 |
0,003 |
|
28 |
Piliostigma thonningii (Fabaceae) |
0 |
2 |
0 |
0 |
0 |
0 |
2 |
0,006 |
|
29 |
Mangifera indica (Anacardiaceae) |
0 |
0 |
0 |
10 |
0 |
0 |
10 |
0,035 |
|
30 |
Combretum molle (Combretaceae) |
0 |
0 |
0 |
0 |
0 |
2 |
2 |
0,006 |
|
31 |
Euphorbia kanerunica (Euphorbiaceae) |
0 |
0 |
0 |
1 |
0 |
0 |
1 |
0,003 |
|
32 |
Anogeisus leiocarpa (Combretaceae) |
0 |
0 |
0 |
2 |
0 |
0 |
2 |
0,006 |
|
33 |
Parkia biglobosa (Fabaceae) |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
0,003 |
|
Totaux |
280 |
1228 |
395 |
8016 |
8966 |
10341 |
29226 |
100 |
|
Tableau 3. Échantillons de miels récoltés en fonction de la richesse taxonomique et spécifique
|
Échantillons de miels |
Richesse taxonomique |
Richesse spécifique |
DDs ( %) |
Interprétation |
|
E1 |
10 |
7 |
70,00 |
Bonne |
|
E2 |
13 |
9 |
69,23 |
Bonne |
|
E3 |
12 |
10 |
83,33 |
Très bonne |
|
E4 |
21 |
14 |
66,66 |
Bonne |
|
E5 |
13 |
11 |
84,61 |
Très bonne |
|
E6 |
21 |
15 |
71,43 |
Bonne |
Légende : DDs : Degré de détermination spécifique
-
Importance des pollens de C. cajan dans le cortège pollinique des miels du site
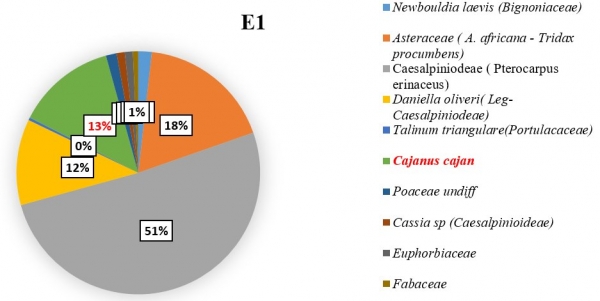
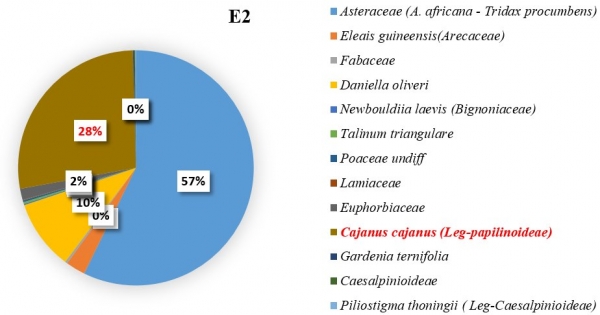
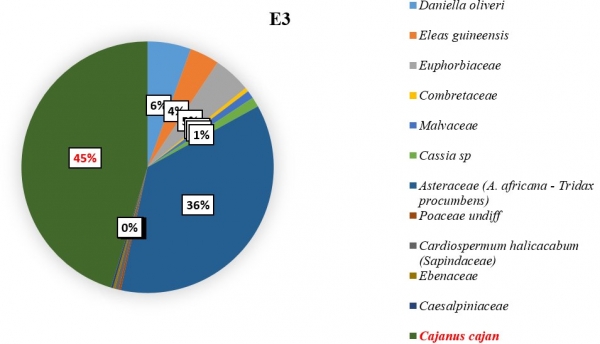
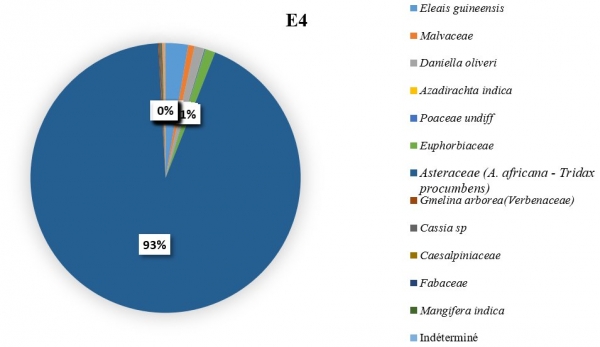
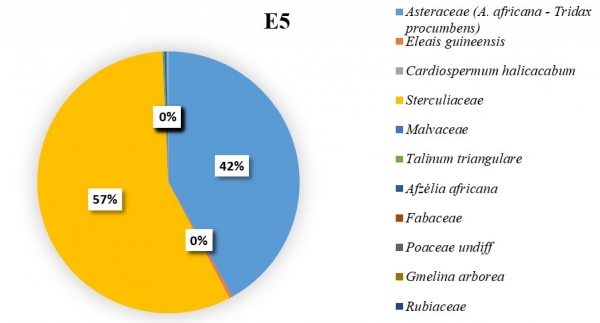
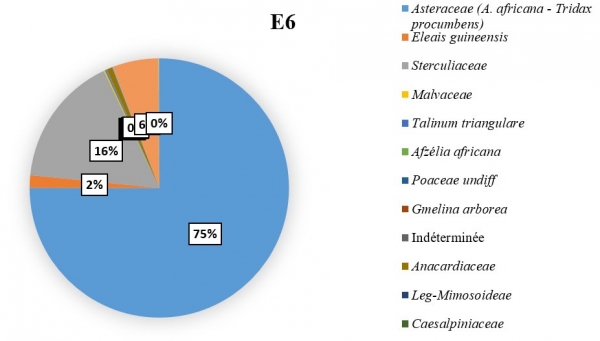
L’importance des pollens du C. cajan revient à apprécier sa représentativité dans les échantillons de miel pendant les six mois de récolte. Il a été constaté que les pollens de Cajanus étaient plus nombreux dans certains échantillons lorsque sa floraison a été maximale. Dans l’échantillon E3 (figure 5), du mois de février il a été dénombré 179 grains de pollens de C. cajan soit 45,33 % des pollens comptés. On les a également retrouvés dans les échantillons E1 (figure 3) avec 37 grains de pollen (13,21 %) du mois de décembre et E2 (figure 4) avec 337 grains de pollen (22,45 %) du mois de janvier. Ils étaient cependant absents dans les échantillons E4, E5 et E6 (figure 6, 7, 8). Les familles des pollens les plus dominantes au niveau de chaque échantillon ainsi que celui de C. cajan au sein des Fabaceae se présentent comme suit :
-
E1 : à dominance des pollens des Fabaceae avec un taux de 64,30 % ; dont C. cajan seule avec un taux de 13,21 % suivi des Asteraceae avec 17,86 %.
Figure 3 : Importance des pollens de Cajanus Cajan dans le mois de décembre
-
E2 : à dominance des pollens des Asteraceae avec un taux de 57,25 % ; suivi des Fabaceae (C. cajan) avec un taux de 27,45 %.
Figure 4 : Importance des pollens de Cajanus Cajan dans le mois de janvier
-
E3 : à dominance des pollens des Fabaceae (C. cajan) avec un taux de 45,33 % ; suivi des Asteraceae avec un taux de 36,45 %.
Figure 5 : Importance des pollens de Cajanus Cajan dans le mois de février
-
E4 : à dominance des pollens des Asteraceae avec un taux de 93,15 %.
Figure 6 : Importance des pollens de Cajanus Cajan dans le mois de mars
-
E5 : à dominance des pollens des Sterculiaceae avec un taux de 56,95 % ; suivi des Asteraceae (41,88 %).
Figure 7 : Importance des pollens de Cajanus Cajan dans le mois d’avril
-
E6 : à dominance des pollens des Asteraceae avec un taux de 75,01 % ; suivi des Sterculiaceae avec un taux de 16,38 %.
Figure 8 : Importance des pollens de Cajanus Cajan dans le mois de mai
C. cajan pourrait-être une plante à la fois pollinifère et nectarifère car d’une part sa morphologie florale a montré la présence des glandes nectarifères sous la corolle au niveau du réceptacle floral et d’autre part la quantité de son pollen dans les échantillons est très variable alors que les miels du site devaient renfermer les mêmes taux de pollen de C. cajan. Les abeilles mellifères qui butinent cette plante préfèrent donc aussi bien le pollen que le nectar. Ceci confirme les observations directes faites sur le terrain lors des activités de butinage où le comportement des abeilles mellifères souligne qu’elles sont à la recherche du nectar mais aussi du pollen. Rabiet (1984) soulignait que les plantes mellifères les plus importantes sont celles qui présentent une productivité nectarifère élevée et régulière.
Conclusion
L’analyse pollinique des six échantillons de miel nous a permis de dénombrer 29 226 grains de pollen. Les proportions des pollens de C. cajan dans ces échantillons de miel sont cependant variables. La représentativité effective des pollens du C. cajan dans les miels est de 45,33 % dans l’échantillon E3, 27,45 % dans l’échantillon E2 et 13,21 % dans E1. Ils n’étaient pas représentés dans les trois autres échantillons (E4, E5 et E6). Il est donc possible de produire du miel monofloral de C. cajan en période maximale (janvier-février) de floraison de C. cajan. Ce miel à C. cajan pourrait être d’une importance capitale dans le traitement des maux soignés par l’espèce. La valorisation du pois d’Angole et la production de miel à dominance C. cajan sont donc à promouvoir pour assurer le bien-être de nos populations par la médecine traditionnelle.